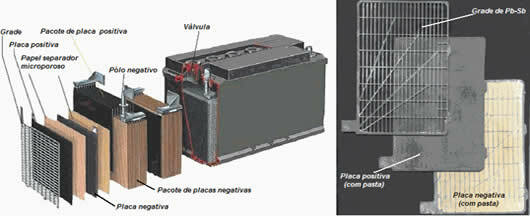
Stanice ili elektrokemijske stanice i baterije uređaji su u kojima se kemijska energija spontano pretvara u električnu.Ćelija se sastoji od samo dvije elektrode i elektrolita, dok je baterija skup baterija u nizu ili paralelno.
Na primarne baterije su uređaji koji se ne mogu puniti, budući da kada prestane reakcija redukcije oksidacije koja se odvija unutar njih, oni se moraju odbaciti.
Za svaku opremu naznačena je vrsta baterije, a među primarnim baterijama koje se trenutno koriste glavne su: Suhe ćelije Leclanchéa (uobičajene baterije ili kiselinske stanice), alkalne baterije i litij / mangan dioksidne baterije.
Pogledajte što ih izdvaja i za koju opremu su prikladni:
- Suhe stanice Leclanchéa:
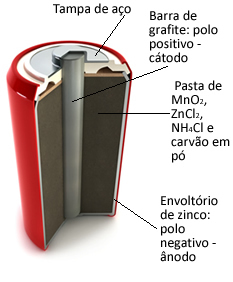
Te su hrpe u osnovi formirane od cinkove ovojnice, odvojene poroznim papirom i središnjom grafitnom pločicom okruženom manganovim dioksidom (MnO2), ugljen u prahu (C) i mokra pasta koja sadrži amonijev klorid (NH4Cl), cinkov klorid (ZnCl2) i vode (H2O).
O cinkov radi poput anoda, gubljenje elektrona; to je grafit radi poput katoda, koji provodi elektrone do mangan-dioksida:
Polovina reakcije anode: Zn (s) → Zn2+(ovdje) + 2 i-
Polureakcija katode: 2 MnO2 (vod.) + 2 NH41+(ovdje) + 2e- → 1 Mn2O3(s) + 2NH3 (g) + 1 sat2O(1)
Globalna reakcija: Zn (s) + 2 MnO2 (vod.) + 2 NH41+(ovdje) → Zn2+(ovdje) + 1 milijuna2O3 + 2NH3 (g)
Ova vrsta baterija prikladna je za opremu koja zahtijeva lagano i kontinuirano pražnjenje, poput daljinskog upravljača, zidnog sata, prijenosnog radija i igračaka.
Više detalja o podrijetlu, funkcioniranju, trajnosti, ddp-u, opasnostima i mjerama opreza koje morate poduzeti s ovim baterijama možete pronaći u tekstu “Leclanché suhi stog”.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
- Alkalne baterije:
Njegov je rad vrlo sličan onome kod suhih stanica Leclanchéa, međutim, jedina je razlika ona umjesto klorida amonija (koji je kisela sol) dodaje se jaka baza, uglavnom natrijev hidroksid (NaOH) ili kalijev hidroksid (KOH).
Polovina reakcije anode: Zn + 2 OH → ZnO + H2O + 2e-
Polureakcija katode: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Ukupna reakcija: Zn +2 MnO2→ ZnO + Mn 2O3

Alkalne baterije su korisnije od kiselih u smislu da imaju veću trajnost, u obično pružaju 50-100% više energije od obične baterije iste veličine, plus postoji manja opasnost od curi.
Uglavnom su naznačeni za uređaje koji zahtijevaju brže i intenzivnije prenošenje, kao što su radio, prijenosni CD / DVD i MP3 uređaji, svjetiljke, digitalni fotoaparati itd.
Pročitajte i tekst Alkalne baterije.
- Litij / mangan dioksid baterije:
Te su baterije lagane i generiraju veliki napon (oko 3,4 V), zbog čega se često koriste u maloj opremi poput satova i kalkulatora. Za razliku od prethodnih slučajeva, njegov je format valuta, kao što je prikazano na sljedećoj slici:

Anoda je litij, katoda mangan-dioksid, a elektrolit fiziološka otopina:
Polovina reakcije anode: čitati →čitati+ + i−
Polureakcija katode: MnO2 + čitati+ + i−→MnO2(li)
Ukupna reakcija: Li + MnO2 → MnO2(li)
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školu ili u akademsko djelo? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Najčešći tipovi ćelija i primarnih baterija"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Pristupljeno 27. lipnja 2021.