aktivni izomeri ili optički aktivni izomeri (IOA) su molekule određene kemijske tvari koje mogu provesti polarizaciju i odstupanje plan od svjetlo desno ili lijevo. Da biste provjerili ima li tvar aktivne izomere, samo provjerite postoji li u strukturnoj formuli asimetrični ugljik:

Analizirajući lanac predstavljen na gornjoj slici, možemo vidjeti da središnji ugljik ima četiri različita liganda (OH, H, CH3 i Cl), što ga čini a ugljik asimetrična, koji se nazivaju i ugljik kiralni. Dakle, kad god lanac ima jedan ili više kiralnih ugljika, bit će aktivnih izomera.
Vas vrste aktivnih izomera(IOA) oni su:
Dešnjak: Aktivni optički izomer koji savija polariziranu svjetlost udesno;
Levogiro: Aktivni optički izomer koji savija polariziranu svjetlost ulijevo.
Promatranje: Prisutnost asimetričnog ugljika u strukturnoj formuli ukazuje na to da tvar mora imati levo-rotacijski izomer i desno-rotacijski izomer. Nije na nama da znamo na koji je način svjetlost bila skrenuta, jer prisutnost kiralnog ugljika već svjedoči o tome. Uvijek je polovica postojećih molekula ljevak, a druga polovica dešnjak.
Molekule ljevoruke i desnoruke bilo koje organske tvari uvijek imaju ista fizikalna svojstva (točka topljenje, vrelište, gustoća, topljivost itd.), ali prisutne kemijske aktivnosti (ponašanje u organizmu) mnogo različitih. Primjer je adrenalin. U tijelu djeluje samo molekula levogire adrenalina, dok dekstrogira ne.
Pogledajte sada strukturnu formulu tvari butan-2-ol kako biste provjerili ima li aktivne izomere ili ne:
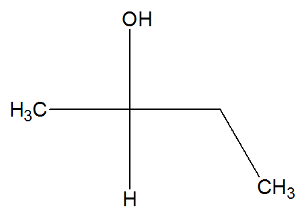
U strukturi butan-2-ola možemo primijetiti da ugljik 2 ima četiri različita veziva (OH, H, CH3, CH2-CH3), pa je to kiralni ugljik i predstavljen je desnokružno aktivni izomer i drugi levorotacijski aktivni izomer.
Proračun aktivnih izomera (IOA)
Nizozemski kemičar Jacobus Henricus van't Hoff razvio formulu koja omogućuje izračunavanje koliko aktivnih izomera (IOA) može dati neka supstanca. Izgled:
IOA: 2Ne
n: je broj kiralnih ugljika u strukturnoj formuli tvari.
Slijedi dva primjera primjene Vant't Hoffove formule:
5-diklor-2,3-dihidroksi-heksandiojska kiselina

U strukturnoj formuli spoja postoje tri kiralni ugljikovi ili asimetrični, dakle:
IOA = 2Ne
IOA = 23
IOA = 8
2,3,4,5-tetrahidroksiheksanal

U strukturnoj formuli spoja postoje četiri kiralni ugljikovi (crvene strelice) ili asimetrični, dakle:
IOA = 2Ne
IOA = 24
IOA = 16
Promatranje: Postoji mogućnost da strukturna formula ima dva asimetrična ugljika koja imaju potpuno iste ligande. Ako se to dogodi, u izračunima uzimamo u obzir samo 1 za vrijednost n, a ne 2. Pogledajte primjer:
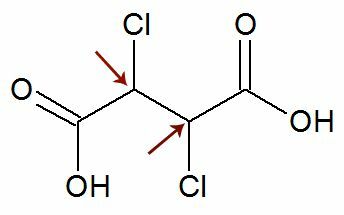
Kao dva kiralna ugljika oni su jednako, smatramo samo jednim ugljik u izračunu:
IOA = 2Ne
IOA = 21
IOA = 2
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm

