U tekstu "Naslov ili masni postotak”Vidjeli smo kako izračunati omjer između mase otopljene tvari i mase otopine za krute, tekuće i plinovite otopine. Međutim, u ovom ćemo tekstu vidjeti da je moguće izračunati i titar u smislu volumena za otopine s tekućim ili plinovitim komponentama.

Naslov u volumenu može se izračunati izrazom:
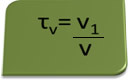
Razmotrimo kao primjer vodenu otopinu etilnog alkohola koja se koristi kao antiseptik i dezinficijens, a koja je pripremljen dodavanjem 70 ml čistog alkohola u dovoljno vode da se dobije volumen od 100 ml riješenje. Tako imamo:
τ = 70 ml = 0,7
100 ml
Naslov možemo izraziti i u postocima, samo pomnoživši rezultat sa 100%. Dakle, u ovom slučaju imamo 70% otopine etilnog alkohola, što znači da je od svakih 100 volumenskih jedinica otopine 70 volumenskih jedinica alkohola.
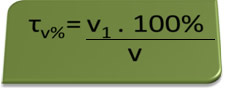
U donjem slučaju imamo 70% otopinu etilnog alkohola u 250 ml otopine; što znači da je 175 ml alkohola, prema izračunima:
100 ml 70 ml alkohola
250 ml x
x = 70. 250
100
X = 175 ml alkohola

Međutim, ne možemo reći da u ovom slučaju imamo 75 ml (250-175) vode. Za razliku od masenog titra, u kojem masi otapala možemo dodati masu otapala kako bismo pronašli masu otopine, to se ne može učiniti u odnosu na volumski titar.

To znači da volumen otopine nije jednak zbroju volumena otapala i volumena otopljene tvari (iako se često razlika može smatrati zanemarivom). To je zato što intermolekularne sile koje postoje u tim tekućinama utječu na konačni volumen.
U slučaju gore spomenute otopine, na primjer etilnog alkohola, kada miješamo alkohol s vodom, dolazi do skupljanja ukupnog volumena otopine; to jest, konačni volumen bit će manji nego kad bismo dodali količinu samo alkohola i vode. To je zato što molekule alkohola uspostavljaju veze ili vodikove veze s molekulama vode, smanjujući razmake između njih.
Stoga se u ovom i drugim slučajevima volumen otopine mora eksperimentalno izmjeriti ako nije predviđen u vježbi.
Volumenski postotak se široko koristi u slučajevima alkoholnih pića i komercijalnog alkohola, kao što je gore spomenuto. Pogledajte dvije važne primjene ovog izračuna:
- Alkotest: alkotest mjeri koncentraciju etilnog alkohola u krvi, a u Brazilu je zabranjeno voziti bilo koju vrstu vozila sa sadržajem alkohola u krvi jednakim ili većim od 0,1% volumena. Osoba s ovim udjelom alkohola za svaku litru krvi ima 1 ml alkohola, što pokazuju sljedeći izračuni:
τv%=V1. 100%
v
0,1 % = V1. 100%
1L
V1 = 0,1% → V1 = 0,001 L = 1 ml
100%

- Sadržaj etanola u benzinu: u Brazilu se benzin regulira dodatkom etanola. Ali sadržaj etanola u benzinu mora biti najviše 24 volumnih% bezvodnog alkohola (budući da benzin ne smije imati vodu). Što se više benzina dodaje etanolu, to gorivo postaje svjetlije i gustoća raste.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/titulo-volume-uma-solucao-quimica.htm

