U reakcije zbrajanjau alkeni(ugljikovodici koji imaju dvostruku vezu između dva atoma ugljika), pi veza između dva ugljika se prekida i svaki od ugljika veže se za novi atom. Izgled:
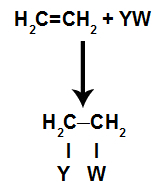
Općeniti shematski model reakcije adicije
Načela reakcije adicije
a) Prekid pi veze
Pi veza lako se prekida jer je slabija veza od sigma veze. Međutim, da bi se to dogodilo, potrebno je da alken bude podvrgnut uvjetima koji osiguravaju taj poremećaj. Nakon prekida veze pi između dva ugljika, mjesto vezivanja (za nove atome) uvijek se pojavi na svakom od uključenih ugljika.
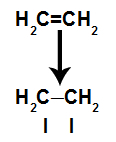
Shema koja prikazuje prekid pi veze
b) Uvjeti za pucanje pi veze
Čimbenici koji favoriziraju pucanje pi veze su:
Upotreba katalizatora;
Grijanje;
Prisutnost kiseline u reakcijskom mediju.
c) Pojava reakcije adicije
Vezna mjesta stvorena nakon pucanja pi-veze uvijek će biti zauzeta atomima reaktanta koji se nalazi u istom spremniku kao i alken. Reakcija dodavanja nazvana je prema vrsti reagensa pomiješanog s alkenom.
Vrste reakcija sabiranja u Alkenima
a) Hidrogeniranje
Alken se miješa s plinovitim vodikom (H2) u spremniku i podvrgnut djelovanju čvrstog katalizatora (nikal, platina ili paladij) i zagrijavanju (Δ).
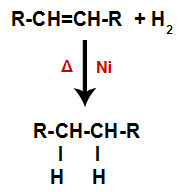
Opća shema reakcije hidrogeniranja u alkenima
Prisutnost katalizatora i zagrijavanje uzrokuju pi vezu alkena i sigma vezu između vodika H2 biti brže slomljen. Uz to, imamo stvaranje dva mjesta vezivanja u alkenu i dva slobodna atoma vodika u reakcijskom mediju.

Stvaranje mjesta vezivanja i razdvajanja atoma
Dakle, odmah nakon toga svaki slobodni atom vodika zauzima jedno od mjesta vezivanja nastalih u alkenu. Kako tvar koja nastaje ima samo ugljik i vodik, kao i samo jednostavne veze između ugljika, to je a alkan.
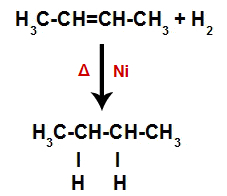
Jednadžba koja predstavlja stvaranje alkana u hidrogeniranju
B) Halogenizacija
Alken se miješa s jednostavnim tvarima (F2, Cl2, br2 Hej2) nastala od halogeni (klor, fluor, jod i brom) u spremniku i podvrgnut djelovanju svjetlosti (λ) i zagrijavanju (Δ).

Opća shema reakcije halogeniranja u alkenima
Djelovanjem svjetlosti i zagrijavanjem brže se prekidaju pi veza alkena i sigma veza između tvari koje tvori halogen. Ovime imamo stvaranje dva mjesta vezanja u alkenu i dva slobodna atoma halogena u reakcijskom mediju.

Stvaranje mjesta vezivanja i razdvajanja atoma
Dakle, odmah nakon toga, svaki slobodni atom halogena zauzima jedno od mjesta vezivanja nastalih u alkenu. Kako nastala tvar ima halogen povezan sa strukturom koja se sastoji od ugljika i vodika, ona je organski halid.

Jednadžba koja predstavlja stvaranje organskih halogenida u halogeniranju
c) Hidratacija
Alken se pomiješa s vodom (H2O) u spremniku i podvrgnut djelovanju katalizatora (u ovom slučaju sumporne kiseline).
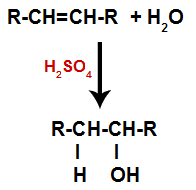
Opća shema reakcije hidratacije u alkenima
Prisutnost sumporne kiseline u reakciji ubrzava pucanje pi veze alkena i sigme veze između vodika (H) i hidroksila (OH) vode. Uz to, imamo stvaranje dva mjesta vezivanja u alkenu i jednog slobodnog vodika i jednog hidroksila u reakcijskom mediju.
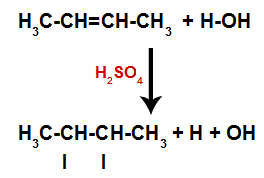
Stvaranje mjesta vezivanja i razdvajanja atoma
Dakle, ubrzo nakon toga, vodik i hidroksil zauzimaju jedno od mjesta vezivanja nastalih u alkenu. Kako se nastala tvar hidroksilno veže za zasićeni ugljik (stvara samo jednostavne veze), to je alkohol.
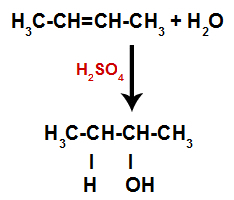
Jednadžba koja predstavlja stvaranje alkohola u hidrataciji
d) Dodavanje vodikovim halogenidima
Alken se u posudi pomiješa s halogeniranom anorganskom kiselinom (HF, HI, HCl, HBr).

Opća shema reakcije kiselinskog halogenida u alkenima
Prisutnost kiseline u reakciji dovodi do bržeg pucanja pi veze alkena. Pojedinačna veza u kiselini je prekinuta jer se te tvari prirodno ioniziraju. Tako se u alkenu stvaraju dva vezna mjesta i u reakcijskom mediju je prisutan slobodni vodik i halogen.
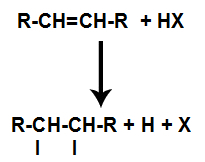
Stvaranje mjesta vezivanja i razdvajanja atoma
Dakle, nedugo zatim, vodik i halogen zauzimaju jedno od mjesta vezivanja nastalih u alkenu. Kako nastala tvar ima halogen povezan sa strukturom koja se sastoji od ugljika i vodika, to je organski halid.
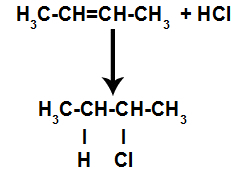
Jednadžba koja predstavlja stvaranje organskih halogenida u halogeniranju
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm
