Oksidacija energije u alkini je organska reakcija koja se događa kada se u kiselu otopinu doda alkin (ugljikovodik koji ima trostruku vezu između dva ugljika) reagens od baeyer (Kalijev permanganat - KMnO4).
NAPOMENA: Reakcija oksidacija energije može se izvesti s kalijevim dikromatom (K2Cr2O7), a ne samo kalijev permanganat.
Kad god se reakcija od provodi se energetska oksidacija u alkinima, proizvodi koji mogu nastati jesu karboksilne kiseline, voda (jedina stavka koja se pojavljuje u bilo kojem od njih) i ugljični dioksid (CO2).
Baeyer-ov reagens u kiselom mediju
Kada se Baeyerov reagens pomiješa s vodom, u prisutnosti a kiselina (tvar sposobna za oslobađanje H iona+), dolazi do stvaranja dvoje oksidi (kalijev oksid i manganov oksid II) i novonastali kisici ([O]).

Mehanizmi oksidacije energije u alkinima
1. mehanizam: prekidajući trostruku vezu.
U početku trostruku vezu napadaju novonastali kisik stvoren Baeyerovim reagensom. Ovaj napad uzrokuje potpuno prekidanje trostruke veze.
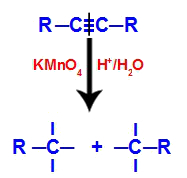
Prekid trostruke veze napadom kisika u nastajanju
Kad se trojna veza prekine, alkin se podijeli na dva dijela. Na svakom ugljiku koji se trostruko vezao pojavljuju se tri slobodne valencije.
2. mehanizam: Interakcija hidroksilnih skupina
Svaku slobodnu valenciju na ugljiku gdje je bila trostruka veza zauzimaju hidroksilne skupine (OH), tvoreći poliol (alkohol s nekoliko hidroksila).
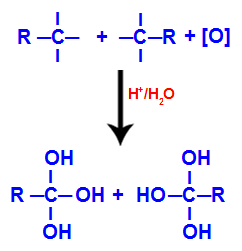
Stvaranje poliola s hidroksilnim skupinama nakon cijepanja trostruke veze
BILJEŠKA: Ako je na ugljiku gdje je bila trostruka veza povezan atom vodika, taj atom vodika primit će kisik u nastajanju i također stvoriti drugi hidroksil.
3. mehanizam: Stvaranje molekula vode
Kada ugljik ima dvije ili više OH skupina, on postaje vrlo nestabilna struktura zbog prisutnosti izuzetno elektronegativi. Dakle, zbog nestabilnosti, molekula prolazi samodehidraciju, odnosno hidroksil se veže za hidronij (H+) iz drugog hidroksila i stvara vodu.

Stvaranje molekula vode iz dva hidroksila prisutna u formiranom poliolu
4. mehanizam: Stvaranje proizvoda
Nakon stvaranja molekula vode, ugljik gubi vezu zbog izlaska iz hidroksil, a kisik drugog hidroksila također gubi vezu koja je stvorena s vodik. Stoga se između ovog ugljika i kisika pojavljuje dvostruka veza koja tvori karbonil (C = O) i stabilizira oboje.
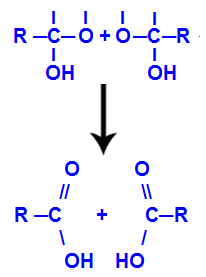
Stvaranje karbonila u dvije strukture dobivene iz alkina
Primjer jednadžbe energetske oksidacije alkina
Primjer: Energetska oksidacija But-1-ino
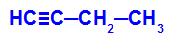
Strukturna formula but-1-yne
Kada se but-1-yne stavi u medij koji sadrži Bayer-ov reagens, vodu i kiselinu, veza pukne. trostruko postoji između ugljika 1 i 2, zbog napada novonastalih kisika koji postoje u sredini, kao u jednadžbi dolje:
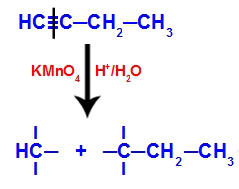
Prekid veze but-1-yne
Nakon prekida trostruke veze, ugljik 1 i 2 dobivaju tri hidroksila, ali ugljik 1 imat će još jednog jer imao je atom vodika (koji se veže za kisik u nastajanju), tvoreći dva poliola (fragmenti 1 i 2).

Jednadžba koja predstavlja stvaranje poliola
Ubrzo nakon što su polioli nestabilni, iz hidroksila nastaju molekule vode. U fragmentu 1 pojavljuje se molekula vode (jer postoje tri hidroksila), a u fragmentu 2 dvije molekule (jer postoje četiri hidroksila).
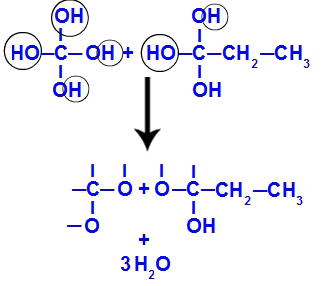
Stvaranje molekula vode iz fragmenata but-1-yne
Konačno, imamo dvostruku vezu između ugljika koji su izgubili hidroksil i kisika koji su izgubili vodik, što dovodi do karbonila.

Stvaranje karbonila u fragmentima but-1-yne
Gornjom jednadžbom možemo vidjeti da je but-1-in stvorio karboksilnu kiselinu i ugljični dioksid (CO2).
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm
