Možemo to primijetiti kad god povećamo koncentraciju jednog ili svih reaktanata koji sudjeluju u kemijskoj reakciji, dolazi do povećanja njegove brzine razvoja, odnosno brzine reakcije.
Tačno je i suprotno. Primjerice, trenutno se preporučuje da umjesto uobičajenog alkohola koristimo alkoholni gel, jer je manji rizik od njegovog sagorijevanja i tako izbjegavanja nesreća. Obični tekući alkohol zapravo je mješavina alkohola i vode, a alkohol u gelu sadrži manju količinu alkohola. Stoga, kada se koncentracija jednog od reaktanata izgaranja smanji, u slučaju alkohola, reakcija teče sporije. S druge strane, što je alkohol čistiji, reakcija izgaranja je brža.

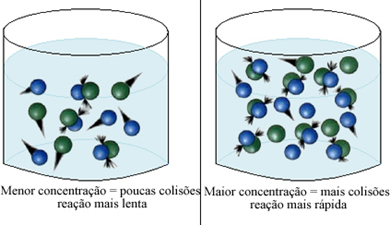
Kao što je navedeno u tekstu Uvjeti za pojavu kemijskih reakcija, jedan od uvjeta za reakciju je učinkovit sudar između čestica. Tako, povećanje koncentracije reagensa omogućuje veću količinu čestica ili molekula u istom prostoru. To povećava količinu sudara između njih, a također povećava vjerojatnost da će se dogoditi učinkoviti sudari koji će rezultirati reakcijom. Rezultat je da se reakcija odvija brže.
Da biste to vidjeli, razmislite o sljedećem primjeru: kada imamo gorući žar i želimo da se ovo izgaranje brže obrađuje, puhamo li ili ga ventiliramo? Zašto ovo djeluje?
Pa, jedan od reaktanata u ovoj reakciji izgaranja je kisik u zraku. Kad se tresemo, zračna struja uklanja pepeo koji nastaje tijekom izgaranja, a to olakšava kontakt kisika s žeravicom. Na taj način povećavamo kontakt između reaktanata i ubrzavamo reakciju izgaranja.
Ukratko, imamo:

Pri radu s plinovima jedan od načina povećanja koncentracije reaktanata je smanjite tlak. Kada to učinimo, smanjujemo volumen i posljedično tome dolazi do povećanja koncentracije reagensa.

Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
