U ovom ćemo tekstu vidjeti kako a grafikon promjena fizičkog stanja bilo kojem čista tvar, kako protumačiti ovu vrstu dijagrama i kako je predstavljen grafikon smjesa.
Da bismo to učinili, razmotrimo primjer vode. Zamislite da uzmemo čašu leda na temperaturi od –10 ºC i započnemo postupak zagrijavanja, pod pritiskom od 1 atm. Kako se temperatura povećava, krećući se od -10 ° C do -9 ° C, do -8 ° C i tako dalje, led će ostati u čvrstom stanju dok ne dosegne temperaturu od 0 ° C.
U ovom trenutku počinje se mijenjati u tekuće stanje, odnosno počinje se odvijati fuzija. Temperatura se neće nastaviti povećavati kao prije, već će ostati konstantna na 0 ° C dok se sav led ne otopi:

Nakon topljenja sve krutine, temperatura sustava nastavit će se povećavati sve dok temperatura ne dosegne 100 ° C. Na ovoj temperaturi voda koja je bila u tekućem stanju počet će se mijenjati u parno stanje, odnosno ključat će.
Baš kao što se dogodilo u fuzijska točka, na točki vrenja, temperatura će također ostati konstantna dok sva tekućina ne postane para. Nakon toga, ako nastavimo grijati sustav, temperatura će i dalje rasti:
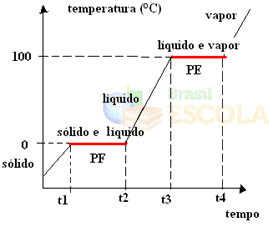
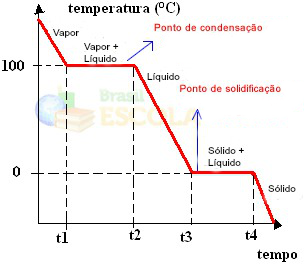
Spreman! Ovo je graf ili dijagram koji predstavljaju promjenu fizikalnog stanja vode ili njezine krivulje zagrijavanja. Da je riječ o inverznom procesu, imali bismo sljedeću krivulju vodenog hlađenja:
Vrlo važan aspekt ovih grafova je da ih čine dvije razine, odnosno postoje dvije točke u kojima temperatura neko vrijeme ostaje konstantna. To se uvijek događa u promjeni stanja čiste tvari. Jedina razlika su vrijednosti tališta i vrelišta.
Kisik, na primjer, za razliku od vode, nije tekućina, već plin na sobnoj temperaturi (oko 20 ° C). To je zato što mu je točka topljenja na razini mora -223,0 ° C, a točka ključanja -183,0 ° C. Pogledajte tablicu promjena fizičkog stanja:

Uobičajena kombinacija grafika
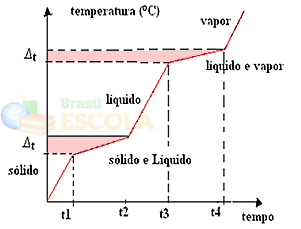
Ako smjesu zagrijavamo ili hladimo, točka topljenja i vrelišta neće imati utvrđene i konstantne vrijednosti, odnosno neće se formirati dvije razine promatrane na grafikonima iznad.
Promjene u fizičkim stanjima dogodit će se u rasponima temperatura, a ne u fiksnoj količini. Točka topljenja, na primjer, započet će na određenoj temperaturi, a završit će na drugoj, a isto će se dogoditi i s vrelištem, kao što je prikazano na sljedećem grafikonu:
Dvije su iznimke eutektičke i azeotropne smjese. Pogledajte što im se događa:
a) eutektička smjesa
Eutektička smjesa ponaša se kao da je čista tvar tijekom fuzije, odnosno u tom trenutku temperatura ostaje konstantna od početka do kraja promjene agregacijskog stanja.

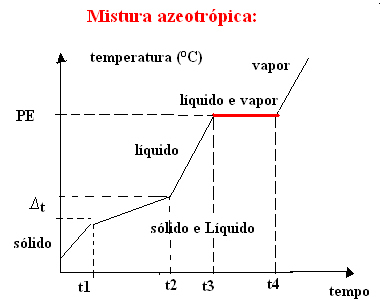
b) azeotropna smjesa
Azeotropna smjesa ponaša se kao čista tvar tijekom vrenja, tj. U ovom trenutku temperatura ostaje konstantna od početka do kraja promjene agregacijskog stanja.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/graficos-mudanca-estado-fisico.htm