U svakodnevnom životu i u laboratorijima postoje spontane reakcije i transformacije i druge koje nisu spontane. Na primjer, svo izgaranje je spontana reakcija, jer jednom započeto, nastavit će se dok se ne potroši svo gorivo ili dok ne nestane sav kisik.
S druge strane, elektroliza je nespontani proces, u kojem se električna energija pretvara u kemijsku energiju. Primjer je elektroliza natrijevog klorida (NaCl). Kad električna struja prođe preko ove rastaljene soli, dolazi do redoks reakcija i stvaranja metalnog natrija (Na(s)) i plinoviti klor (Cl2 (g)). Ako zaustavimo električnu struju, reakcija se neće nastaviti sama od sebe, što pokazuje da nije spontana.
Spontanost reakcije može se izmjeriti pomoću Gibbs-Helmholtzova jednadžba, naveden u nastavku:

Na što:
∆G = varijacija slobodne energije;
∆H = promjena entalpije;
T = temperatura u Kelvinima (uvijek pozitivna);
∆S = promjena entropije.
Ova jednadžba dobiva ime jer ju je predložio američki fizičar J. Willard Gibbs (1839-1903) i njemački fizičar Hermann Helmholtz (1821-1894).
Da bismo bolje razumjeli kako nam ova jednadžba pomaže u određivanju spontanosti reakcije, pregledajmo ukratko svaki od koncepata koji su u nju uključeni:
- ∆H (varijacija entalpije): Entalpija (H) je energetski sadržaj tvari. Do sada nije poznat način na koji bi se to moglo utvrditi. U praksi se postiže mjerenje varijabilnosti entalpije (∆H) postupka pomoću kalorimetara. Ova je varijacija iznos od energija koja je u tom procesu oslobođena ili apsorbirana.
- ∆S (varijacija entropije):Entropija (S) je termodinamička veličina koja mjeri stupanj poremećaja u sustavu.
Primjerice, pri topljenju leda molekule prelaze iz čvrstog u tekuće stanje, gdje dolazi do veće neorganiziranosti. To znači da se u ovom procesu entropija povećala (∆S> 0).
U proizvodnji amonijaka (NH3), 1 mol dušikovog plina reagira s 3 mola plinovitog vodika (to jest 4 mola molekula u reaktantima), dajući 2 mol amonijaka:
N2 (g) +3 H2 (g) → 2 NH3 (g)
Budući da se u ovom procesu smanjuje broj molekula u plinskoj fazi, dezorganizacija se smanjila, što znači da se smanjila i entropija (∆S <0).
- ∆G (besplatna energija): Besplatna energija odn Gibbsova besplatna energija (jer ju je 1878. predložio samo ovaj znanstvenik) je korisna energija sustava koji se koristi za obavljanje posla.
Sustav ima globalnu energiju, ali samo će se dio te energije upotrijebiti za obavljanje posla, to se naziva Gibbsova besplatna energija, koju simbolizira G.
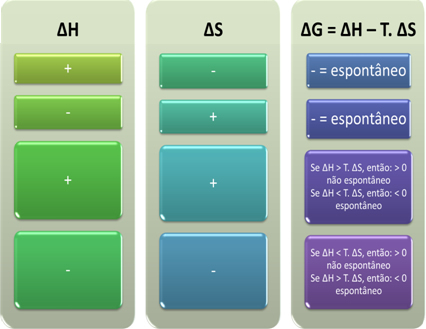
Prema Gibbsu, postupak se smatra spontanim ako izvodi posao, odnosno ako se G smanji. U tom će slučaju završno stanje transformacije biti stabilnije od početnog kada je ∆G <0.
Na temelju toga možemo zaključiti sljedeće:

Također možemo vidjeti hoće li proces biti spontan gledajući algebarski znak ∆H i ∆S u Gibbs-Helmholtzovoj jednadžbi:
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm
