Kao što je objašnjeno u tekstu Reakcije adicije, ove organske reakcije obično se javljaju sa spojevima koji imaju nezasićenje (dvostruke veze ili trojke), kod kojih je pi veza prekinuta, omogućujući ulazak atoma ili skupina atoma u lanac. karbonska.
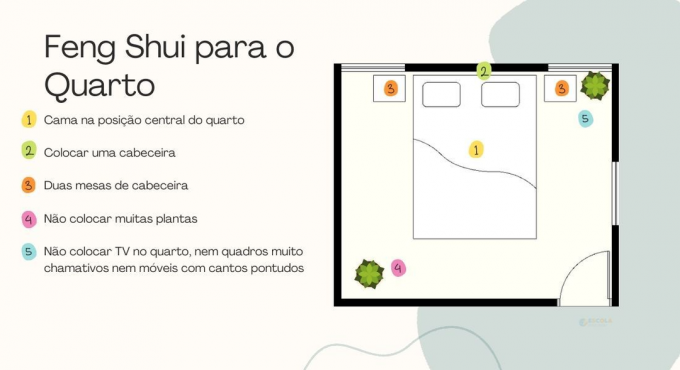
Međutim, ova vrsta reakcije javlja se i u slučaju cikloalkani (ugljikovodici zatvorenog lanca sa samo zasićenim (jednostavnim) vezama između ugljika) koji imaju tri ili četiri atoma ugljika. Primijetite donji primjer, a to je bromiranje (reakcija halogeniranja) ciklopropana:
CH2
/ \ + br2 → br ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Isto tako, postoji i reakcija dodavanja koja se naziva hidrohalogeniranje ili dodavanje halida, kao što je prikazano dolje:
CH2
/ \ + HBr → H ─ CH2 ─ CH2 ─ CH2 ─ br
H2C CH2
Imajte na umu da je u oba slučaja molekula slomljena i proizvedeni su spojevi otvorenog lanca.
Ali to se ne događa tako lako u cikloalkanima s pet ili više atoma ugljika. S druge strane, veća je vjerojatnost da će ti spojevi uspjeti supstitucijske reakcije, u kojem veza nije prekinuta, već su jedan ili više atoma vodika vezanih za ugljik zamijenjeni atomima drugih elemenata.
Ciklopentan još uvijek može provoditi reakcije dodavanja, ali samo na višim temperaturama (oko 300 ° C). U slučaju cikloheksana, to je vrlo teško. Ono što zapravo čini su reakcije zamjene, poput sljedeće kloriranja:
CH2 CH2
/ \ / \
H2C CH2 H2C CH ─ Kl
│ │ + Kl2→ │ │ + HKl
H2C CH2 H2C CH2
\ / \ /
CH2 CH2
Prstenovi s pet ili više atoma ugljika dodatno ne reagiraju s halogenovodičnim kiselinama, poput HBr.
Ali zašto se to događa? Zašto cikloalkani s tri ili četiri ugljika provode reakcije adicije, a cikloalkani s više atoma ugljika obično ne?
Pa to je zato što su ciklopropan i ciklobutan nestabilniji, pa je lakše prekinuti njihove veze.

Johann Friedrich Adolf von Bayer (1835.-1917.)
Da bi to objasnio, njemački kemičar Johann Friedrich Adolf von Bayer (1835.-1917.) Razvio je 1885. godine tzv. Teorija prstenastog naprezanja, koja je to pokazala četiri veze koje stvaraju atomi ugljika bile bi stabilnije kad bi imale kut jednak 109º 28 ', kao što je slučaj sa sljedećim metanom:

Četiri pojedinačne veze metana imaju kut od 109 ° 28 '
Ovo je najstabilniji kut jer odgovara najvećoj mogućoj udaljenosti između atoma u tetraedarskoj geometriji. Ovim se elektroničko odbijanje (odbijanje između elektrona u valentnim slojevima atoma) smanjuje.
Cikloalkani s tri, četiri i pet ugljika imaju kutove veze između ugljika manjih od 109 ° 28 '. Izgled:

Kutovi cikloalkanskih veza
Na temelju ovih stvarnih kutova, koje općenito možemo nazvati α, izračun naprezanja veze može se izvršiti pomoću sljedeće formule:
napetost = 109º 28' - α
2
Znamo da je ciklopropan najnestabilniji i ujedno i najreaktivniji cikloalkan, a to se potvrđuje izračunavanjem napona njegovog prstena u usporedbi s ostalima:
napon ciklopropana = 109º 28' – 60º = 109º – 60º + 28' = 49º + 28' = 24,5º + 14
2 2 2
Kako je 0,5º = 30, imamo:
napon ciklopropana = 24º + 30 '+ 14' = 24º 44'
napon ciklobutana = 109º 28' – 90º = 9º 44'2
napon ciklopentana = 109º 28' – 108º = 0º 44'2
Prema Bayerovoj teoriji napetosti, što je veća ta napetost, to će ciklan biti nestabilniji, to jest to će biti veća razlika između stvarnog kuta (α) i teoretskog kuta (109º 28 '), nestabilnija i posljedično reaktivnija bit će supstancija.
Zbog toga je ciklopropan najmanje stabilan od cikloalkana.
Međutim, došlo je do pogreške u Bayerovoj teoriji, jer ako nastavimo raditi ovaj proračun stresa za cikloheksan, gdje je kut veze 120 °, vidjet ćemo da će vrijednost biti još manja od vrijednosti ciklopropana, što daje jednako -5 ° 16 '. To bi ukazalo na činjenicu da bi cikloheksan trebao biti još nestabilniji i provoditi reakcije dodavanja, što u praksi nije slučaj.
Objašnjenje ove činjenice pronašao je 1890. godine njemački kemičar Hermann Sachse, a 1918. godine također njemački kemičar Ernst Mohr. Prema tim znanstvenicima, pogreška u Bayerovoj teoriji naprezanja prstena ležala bi u činjenici da je smatrao da su svi cikloalkani koplanarni, odnosno da su svi njihovi atomi ugljika u jednoj ravnini, suradnikm crteži njihovih struktura prikazani gore.
Međutim, u stvarnosti prstenovi cikloalkana s više od pet atoma ugljika nisu ravni, već njihovi atomi. stječu prostorne konformacije koje poništavaju napetosti između spojeva, uspostavljajući kut od 109 ° 28 'između Veze.
Na primjer, pogledajte slučaj cikloheksana. Zapravo nije ravan s kutom od 120 ° između svojih veza, već se zapravo njegovi atomi "vrte", tvoreći dvije moguće konformacije, konformaciju "stolice" i "čamca":

Moguće konformacije cikloheksana u praksi
Imajte na umu da je, jer je stvarni kut cikloheksana jednak 109 ° 28 ', vrlo stabilan spoj, tako da se njegova molekula ne razbija, pa ne sudjeluje u reakcijama dodavanja. Također imajte na umu da je oblik "stolice" najstabilniji, budući da uvijek prevladava u mješavinama jer su u ovoj konformaciji atomi vodika vezani za ugljik međusobno udaljeni. drugi.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/teoria-das-tensoes-dos-aneis-bayer.htm