Reakcije istiskivanja, također nazvan supstitucijske reakcijeili još iz jednostavna razmjena, su oni koji se javljaju kada jednostavna tvar (koju čini jedan element) reagira sa složenom tvari, "premještajući" potonju u novu jednostavnu tvar.
Općenito, možemo ga definirati kako slijedi:
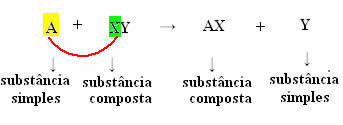
Ali da bi se to dogodilo, jednostavna tvar, u slučaju koji simbolizira A, mora biti reaktivniji od elementa koji će biti istisnut iz spoja, pretvarajući se u novu jednostavnu supstancu (Y).
Pogledajmo primjer gdje se javlja ova reakcija:
Promatrajte donji eksperiment u kojem se lim cinka (Zn) stavi u vodenu otopinu bakrenog sulfata (CuSO4). Tijekom vremena primijećeno je da se otopina bakrenog sulfata mijenja iz plave boje u manje intenzivnu plavu, jer je promijenila boju i na cinkovom limu je bilo naslaga bakra.

Ovu reakciju možemo predstaviti pomoću sljedeće kemijske jednadžbe:

Imajte na umu da je cink istisnuo bakar, što znači da je cink najreaktivniji.
Budući da su oba metala, možemo provjeriti hoće li se dogoditi jednostavna reakcija izmjene ili ne analizirajući red reaktivnosti metala prikazano ispod:

Imajte na umu da je bakar zapravo manje reaktivan od cinka, pa ako smo odlučili učiniti suprotno od prethodnog pokusa i stavite bakreni lim u otopinu cinkovog sulfata, reakcija se neće dogoditi, jer bakar neće moći istisnuti cinkov.
Reakcije istiskivanja vrsta su redoks reakcije jer dolazi do prijenosa elektrona iz jednostavne tvari u kompozit. U gore objašnjenom postupku, cink je u početku bio u svom neutralnom obliku, koji je metalni, i postao dio spoja u kojem ima 2+ naboja, odnosno svaki atom cinka izgubio je dva elektroni. Kod bakra se događa suprotno, on prima dva elektrona za prelazak u metalno, čvrsto stanje.
U slučaju jednostavne reakcije izmjene s nemetalima, razmatra se: reakcija će se dogoditi samo ako je najreaktivniji nemetal jednostavna tvar koja može istisnuti drugi manje reaktivni nemetal. Reaktivnost metala prikazana je u nastavku:

Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm