THE Teorija okteta navodi da da bi atom kemijskog elementa bio stabilan, mora steći elektroničku konfiguraciju plemenitog plina, to jest mora imati osam elektrona u valentnoj ljusci ili dva elektrona ako atom ima samo prvu elektronsku ljusku. (K).
Berilij ima atomski broj jednak 4. Prema tome, vaš atom ima 4 elektrona i njegova elektronička raspodjela u osnovnom stanju je dana:

Elektronska konfiguracija berilija
To znači da berilij ima 2 elektrona u posljednjoj ljusci, koji su iz porodice 2A (zemnoalkalijski metali). Dakle, imao bi tendenciju doniranja ova dva elektrona, dobivajući naboj 2+, odnosno imao bi tendenciju stvaranja ionskih veza.
Međutim, uočava se da atomi berilija stvaraju kovalentne veze, dijeljenjem elektrona, kao što je prikazano u spoju nastalom dolje, berilijev hidrid (BeH2):
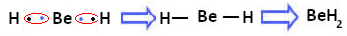
Stvaranje kovalentnih veza berilija s vodikom
Imajte na umu da je u ovom slučaju berilij stabilan s manje od osam elektrona u valentnoj ljusci, jer je dijele svoje elektrone poput atoma vodika, sada u svom posljednjem imaju četiri elektrona sloj. To je, dakle, a iznimka od pravila okteta.
No, kovalentno povezivanje obično se događa jer element ima nepotpune orbitale. Na primjer, kao što je prikazano dolje, vodik ima nepotpunu orbitalu, pa stvara samo jednu kovalentnu vezu. Kisik ima dvije nepotpune orbitale i stvara dvije kovalentne veze. Dušik pak ima tri nepotpune orbitale i, prema tome, stvara tri kovalentne veze:
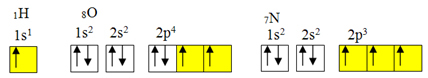
Elektronička raspodjela vodika, kisika i dušika
Međutim, kao što je već prikazano, berilij nema nepotpune orbitale.
Pa zašto stvara kovalentne veze?
Objašnjenje je u teorija hibridizacije, što to govori kad elektron s orbitale primi energiju, on "skoči" na najudaljeniju praznu orbitalu, zadržavanje u pobuđenom stanju i tako dolazi do fuzije ili miješanja nepotpunih atomskih orbitala, generirajući hibridne orbitale koji su međusobno ekvivalentni i različiti od izvornih čistih orbitala.
Na primjer, u slučaju berilija, elektron iz podrazine 2s prima energiju i prelazi na praznu orbitalu podrazine 2p:

Uzbuđeno stanje berilija za stvaranje hibridnih orbitala
Na taj način berilij ima dvije nepotpune orbitale, budući da može stvoriti dvije kovalentne veze.
Imajte na umu da je jedna orbitala u podrazinu "s", a druga u "p", tako da bi vezivanja koja bi berilij trebao izvesti trebali biti različiti. Međutim, to se ne događa, jer s fenomenom hibridizacija, ove nepotpune orbitale koje su nastale miješati će se generirajući dvije tzv hibridi ili hibridizirano, koji su međusobno jednaki. Nadalje, budući da su ove dvije hibridne orbitale došle s orbitale "s" i "p", kažemo da je ta hibridizacija tipa sp:

Formiranje hibridizacije Beryllium sp
Budući da su hibridne orbitale iste, kovalentne veze koje berilij stvara s atomima vodika također će biti iste:

Interpenetracije hibridnih berilijevih orbitala s s orbitala vodika
Imajte na umu da tada stvara dvije sigma veze tipa s-sp (σs-sp).
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm

