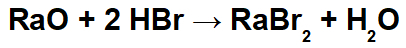Reakcije redukcije oksidacije proučavane uglavnom u Fizikalnoj kemiji su one u kojima dolazi do prijenosa elektrona. Reakcijska vrsta (atom, ion ili molekula) koja izgubi jedan ili više elektrona je ona koja prolazi oksidaciju. S druge strane, smanjuje se kemijska vrsta koja prima elektrone.
Općenito, kada se ova vrsta reakcije proučava u anorganskoj kemiji, ona se naziva jednostavna reakcija razmjene ili raseljavanja.
Da bi se dogodila bilo kakva reakcija potrebno je zadovoljiti određene uvjete. Jedan od njih je da mora postojati kemijski afinitet između reagensa, odnosno moraju međusobno djelovati na takav način da omoguće stvaranje novih tvari.
U slučaju redoks reakcija, afinitet znači da jedan od reaktanata teži dobivanju elektrona, a drugi da gubi elektrone. Ovaj trend odgovara reaktivnost uključenih kemijskih elemenata.
Pogledajmo kako je moguće usporediti reaktivnost među metalima.
Pretpostavimo da želimo pohraniti otopinu bakar II sulfata (CuSO4). Ovu otopinu nikako nismo mogli smjestiti u aluminijsku posudu jer bi se dogodila sljedeća reakcija:
2 Al(s) + 3 CuSO4 (vod.)→ 3 Cu(s) + Al2(SAMO4)3 (vod.)
Imajte na umu da je aluminij oksidirao, izgubivši po 3 elektrona i postao aluminij-kation:
Al(s) → Al3+(ovdje) + 3 i-
Istodobno, kation bakra (Cu2+) koji je bio prisutan u otopini, primio je elektrone iz aluminija i reducirao se, postajući metalni bakar. Svaki kation bakra prima dva elektrona:
Dupe2+(ovdje) + 2 i- → Cu(s)
Međutim, ako je bilo obrnuto i htjeli smo pohraniti otopinu aluminij-sulfata (Al2(SAMO4)3 (vod.)), ne bi bio problem staviti je u bakrenu posudu jer se ova reakcija ne bi dogodila:
Dupe(s) + Al2(SAMO4)3 (vod.) → ne javlja se
Ove uočene činjenice mogu se objasniti činjenicom da aluminij je reaktivniji od bakra.
Metali imaju tendenciju odustajanja od elektrona, odnosno oksidacije. Kada se uspoređuju različiti metali, onaj s najvećom tendencijom doniranja elektrona je najreaktivniji. Posljedično, reaktivnost metala je također povezana s njihovom energija ionizacije, odnosno minimalna energija potrebna za uklanjanje elektrona iz plinovitog atoma u osnovnom stanju.

Na temelju ovoga, red reaktivnosti metala ili red elektrolitskih napona, prikazano ispod:

Najreaktivniji metal reagira s ionskim tvarima čiji su kationi manje reaktivni. Drugim riječima, metal s lijeve strane reagira s tvari koju tvore ioni s njegove desne strane. Ne događa se suprotno.
Prisjećajući se navedenog primjera, u retku reaktivnosti pogledajte da je aluminij (Al) lijevo od bakra (Cu). Stoga aluminij reagira s otopinom koju tvore kationi bakra; ali bakar ne reagira s otopinom koju tvore kationi aluminija.
Imajte na umu da je najreaktivniji metal litij (Li), a najmanje reaktivan zlato (Au).

To je jedan od razloga zašto je zlato toliko vrijedno, jer ako ne reagira, dugo ostaje netaknuto. To se može vidjeti u egipatskim sarkofazima obloženim zlatom i skulpturama koje potječu iz najudaljenije antike. To također vizualiziramo kada uspoređujemo trajnost nakita od čistog zlata s nakitom izrađenim od drugih metala koji su reaktivniji od zlata.

Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/ordem-reatividade-dos-metais.htm