Uzmite u obzir sljedeću kemijsku ravnotežu pri konstantnoj temperaturi:
3 sata2 (g) + N2 (g) ↔ 2 NH3 (g)
Prema Gay-Lussac-u, udio volumena plinovitih sudionika u reakciji jednak je omjeru odgovarajućih stehiometrijskih koeficijenata. Jednostavno rečeno, možemo reći da je broj molekula prisutnih u reaktantima i produktima jednak koeficijentima u jednadžbi.
U slučaju gore, u reagensima imamo 4 molekule, a u proizvodima 2 molekule, što znači da je volumen reagensa veći, a količina proizvoda manja.
Ako povećamo tlak u ovom sustavu, ravnoteža će se pomaknuti prema manjem volumenu kako bi se taj tlak smanjio. U slučaju reakcije koju razmatramo, istiskivanje će biti u izravnom smjeru stvaranja proizvoda (NH3 (g)).
Međutim, ako smanjimo tlak, reakcija će se kretati prema najvećem volumenu, koji je suprotan smjer, stvaranja reaktanata (3 H2 (g) + N2 (g)).
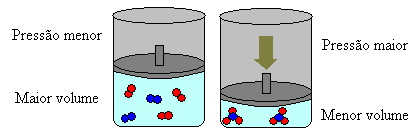
To se događa prema Le Chatelierovom principu, koji kaže da je svaki poremećaj (poput smanjenja ili povećanja pritiska) uzrokovan u sustavu u ravnoteži natjerat će ga da se kreće u smjeru koji minimalizira ovaj poremećaj, prilagođavajući se novom ravnoteža.
Ukratko, u slučaju utjecaja promjene tlaka na kemijsku ravnotežu možemo reći sljedeće:
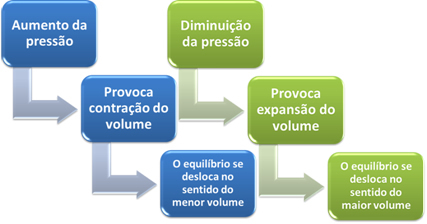
U slučaju reakcija u kojima je volumen reaktanata jednak volumenu proizvoda, kemijska ravnoteža se ne mijenja.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/variacao-pressao-deslocamento-equilibrio-quimico.htm
