Kada kuhamo hranu u svojim domovima, koristimo izgaranje plinova za kuhanje. Jedna od stvari koju možemo vidjeti u plamenu koji nastaje izgaranjem ovog plina je da je njegova boja obično vrlo svijetloplava. Međutim, u većini reakcija izgaranja, poput gorenja svijeće, plamen je žut.

Tada se postavlja pitanje:
"Ako je svaki požar rezultat reakcije izgaranja, zašto neki plamenovi imaju različite boje?"
Da bismo razumjeli kako se to događa, moramo razumjeti što je reakcija izgaranja i koje su tvari prisutne u svakoj od spomenutih reakcija.
Reakcija izgaranja događa se kada oksidans (plinoviti materijal koji sadrži kisik) troši gorivo (oksidirajući materijal) za stvaranje toplinske energije (topline).
Još jedna važna stvar koju moramo znati o reakcijama izgaranja jest da se one mogu odvijati u zraku potpuna ili nepotpuna. Ako ima dovoljno kisika za trošenje goriva, reakcija će biti potpuna i proizvest će se ugljični dioksid (CO2) i vode (H2O). Inače, izgaranje će biti djelomično, nepotpuno, stvarajući ugljični monoksid (CO) i vodu; ili ugljik (C) i voda.
U oba slučaja koje analiziramo, oksidans je kisik prisutan u zraku. Međutim, goriva su različita. Plin za kuhanje zapravo je ukapljeni naftni plin (UNP), koji je smjesa ugljikovodika (alkana), a glavno gorivo je butan (C4H10). Dakle, plin za kuhanje čine molekule alkana koje imaju samo tri ili četiri atoma ugljika, zato je za njegovo izgaranje potrebno malo kisika. Ova reakcija može se izraziti na sljedeći način:
1C4H10 (g) + 13/2 O.2 (g) → 4 CO2 (g) + 5 sati2O(g), ∆H <0
U slučaju svijeća, parafin je gorivo za reakciju, a sastoji se od mješavine alkana s atomima ugljika koja u rasponu od 20 do 36. Time, potrebno je puno više kisika da bi se ova reakcija u potpunosti odvijala. Pogledajte primjer:
1C24H50 (i) + 70/2 O2 (g) → 25 CO2 (g) + 25 H2O(g), ∆H <0
U zraku nema dovoljno kisika za izvođenje ovog potpunog izgaranja, pa se ono odvija nepotpuno, kao što je prikazano dolje:
1C24H50 (i) +49/2 O.2 (g) → 24 CO(g) + 25 H2O(g), ∆H <0
1C24H50 (i) +25/2 O.2 (g) → 24C(s) + 25 H2O(g), ∆H <0
Nepotpune reakcije proizvode manje energije od potpunog izgaranja. To objašnjava razliku između boja plamena, jer žuti plamen, karakterističan za nepotpuno izgaranje, ima nižu energiju. Plavi plamen karakterističan je za potpuno izgaranje, s većom energijom.
To također objašnjava stvaranje čađe u plamenu svijeće (slika dolje), a to je ugljik koji se smatra proizvodom nepotpunog izgaranja.
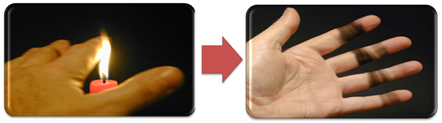
Ali zašto je u Bunsenovom plameniku moguće dobiti žuti i plavi plamen kad se gorivo ne mijenja?
U slučaju Bunsenovog plamenika to se postiže reguliranjem ulaza plina i zraka. Ako je prozor zatvoren, što uzrokuje ulazak male količine zraka, dobiveni plamen bit će žut, jer će imati malo kisika za potpuno izgaranje. Ako je regulacija smjese plin-zrak primjerena, dobit ćemo plavi plamen.
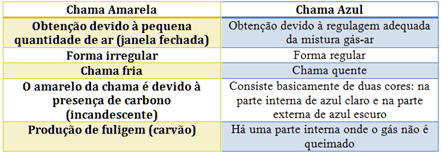
Pogledajte karakteristike svake od njih u donjoj tablici:
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm


