Kiseline i baze dvije su vrste korozivnih tvari, ali se smatraju kemijskim suprotnostima.
Jedna od najvećih razlika između kiselina i baza je ta što baze u dodiru s vodenom otopinom otpuštaju negativne ione, hidroksile (OH-). Kiseline u dodiru s vodom oslobađaju pozitivne ione vodika (H+).
Svaka tvar s pH vrijednošću između 0 i 7 smatra se kiselom, dok je pH vrijednost od 7 do 14 baza. Vrijednost 7 je neutralna, što odgovara vodi.
| kiseline | Baze | |
|---|---|---|
| Definicija Arrheniusa | Kiselina je svaki kemijski spoj koji u vodenoj otopini oslobađa vodikove ione (H+). |
Baza ili lužina je tvar koja u vodenoj otopini otpušta hidroksile, negativne ione (OH-) |
| Definicija Bronsted-Lowryja | Kiselina je tvar koja donira proton. | Baza je svaka tvar koja prima proton. |
| definicija lewisa | Tijekom kemijske veze kiseline su te koje primaju elektronske parove. | U kemijskoj vezi, baze su one koje doniraju elektronske parove. |
| pH vrijednost | Manje od 7,0. | Veći od 7,0. |
| Fizičke karakteristike | Kiseline se mogu pojaviti u krutom, tekućem ili plinovitom obliku, ovisno o temperaturi. | Često u krutom stanju osim amonijaka koji je plin. |
| Struktura | Kiseline su molekularne, odnosno formirane su kovalentnim vezama u kojima se dijele elektroni. | Baze mogu biti ionske ili molekularne. |
| kemijska formula | Kiseline imaju kemijsku formulu s H na početku, na primjer, HCl (klorovodična kiselina). Octena kiselina (ocat) je izuzetak, sa CH3COOH. | Baze imaju OH na kraju svoje formule, na primjer NaOH (natrijev hidroksid). |
| Topivost u vodi | Obično su prilično topljivi u vodi. | Većina baza je praktički netopljiva. |
| Reakcija na indikator fenolftalein | Ostaje bezbojan. | Neka otopina bude ružičasta. |
| Ph test (lakmus papirom) | Pocrveni. | Postaje plavo. |
| Električna vodljivost | Oni provode struju samo kada su otopljeni u vodi. | Oni također provode električnu struju u vodenoj otopini. |
| Primjeri | Octena kiselina, sumporna kiselina. | Natrijev hidroksid, amonijak |
Što su kiseline i baze
Kiseline su ionski spojevi koji kada se otope u vodi stvaraju pozitivan vodikov ion (H+). Baze su, s druge strane, ionski spojevi koji tvore negativno nabijeni hidroksidni ion (OH-) u vodi.
Ova definicija, koju je dao švedski znanstvenik Svante Arrhenius, najčešće se koristi za klasifikaciju kiselina i baza, no postoje i druge definicije.
Definicija koju je dao Johannes N. Bronsted i Thomas Lowry, poznata kao definicija protona, kaže da su kiseline tvari koje doniraju proton, dok su baze one koje prihvaćaju proton.
Prema definiciji koju je dao sjevernoamerikanac Gilbert Newton Lewis, kiseline su tvari koje primaju elektronske parove u kemijskoj vezi, dok baze odaju parove.
pH kiselina i baza
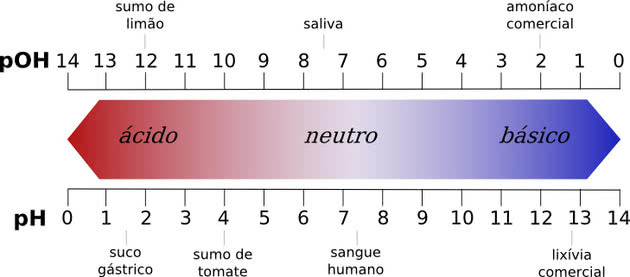
Svi kemijski spojevi imaju pH vrijednost, koja može biti u rasponu od 0 do 14, gdje brojevi predstavljaju koncentraciju vodikovih iona u otopini.
Neutralni pH je pH čiste vode, koji iznosi 7. Svaka tvar s pH vrijednošću između 0 i 7 smatra se kiselom, dok je pH vrijednost od 7 do 14 baza.
Što je kiselina niža od 7,0, to je jača. U bazama, što je viša pH vrijednost, to će biti jači.
Karakteristike kiselina:
- Ima gorak okus;
- Može opeći kožu pri dodiru;
- Može nagrizati metale i kožu;
- Čini lakmus papir crvenim;
- U univerzalnom indikatoru identificira se crvenom ili narančastom bojom.
Karakteristike baza
- Opor okus;
- Prilikom dodira osjećate nešto viskozno;
- Mnoge baze reagiraju s kiselinama i stvaraju soli;
- Jake baze mogu burno reagirati s kiselinama;
- Baze boje lakmus papir plavo;
Indikatori kiselina i baza
pH indikatori ili acidobazni indikatori su tvari koje se koriste da bi se utvrdilo je li otopina kiselina ili baza.
To je moguće zbog njegovih fizikalno-kemijskih svojstava, koja imaju sposobnost mijenjanja boje prema pH vrijednosti ispitivane tvari.
Među brojnim umjetnim indikatorima koji se koriste u laboratoriju najpoznatiji su fenolftalein, lakmus papir i univerzalni indikatori.
- Fenolftalein u dodiru s kiselinom ostaje bezbojan, a u dodiru s bazama postaje ružičast.
- Lakmusov papir postaje plav s bazama, a crven s kiselinama.
- Univerzalni indikator je najprecizniji od kiselo-baznih indikatora jer pokazuje različite boje prema svakoj pH vrijednosti.

Primjena kiselina i baza u svakodnevnom životu
Kiseline se često koriste za uklanjanje hrđe s metala, kao elektrolit u baterijama, za preradu minerala, za proizvodnju gnojiva i benzina, te kao aditive u hrani i pića.
Baze se prvenstveno koriste u čišćenju, kao što su deterdženti za pranje posuđa i sapun za pranje rublja, sredstva za čišćenje pećnica i sredstva za uklanjanje mrlja.



