A sublimacija To je promjena agregatnog stanja tvari koju karakterizira izravan prijelaz iz krute faze u plinovitu fazu, bez prolaska kroz tekuću fazu. Strogo govoreći, svaka tvar može proći sublimaciju, ali pod određenim uvjetima tlaka i temperature. Sublimacija je u korelaciji s tlakom pare u čvrstoj fazi, kao i s međumolekularnim interakcijama koje vrše krute tvari.
Taj se proces lako može uočiti u komadu suhog leda koji se sastoji od krutog ugljičnog dioksida. Ugljični dioksid sublimira pod pritiskom i na sobnoj temperaturi. Proces suprotan sublimaciji može se nazvati resublimacijom ili taloženjem. Da bi došlo do sublimacije, materija mora apsorbirati energiju, pa se smatra endotermnim procesom.
Pročitajte također: Koja su agregatna stanja tvari?
Sažetak o sublimaciji
Sublimacija je izravan prijelaz iz krute faze u plinovitu fazu, bez prolaska kroz tekuću fazu.
Specifični uvjeti tlaka i temperature potrebni su za promatranje sublimacije tvari.
Na sublimaciju utječu termodinamički aspekti, poput tlaka pare u čvrstoj fazi i međumolekulskih interakcija.
Sublimacija je endoterman proces.
Primjer sublimacije je ono što se događa u suhom ledu, koji se sastoji od čvrstog ugljičnog dioksida.
Što je sublimacija?
sublimacija je izravni prijelaz iz krute faze u plinovitu fazu, bez prolaska kroz tekuću fazu. To se događa pod specifičnim uvjetima temperature i tlaka za neke čvrste tvari. Ovaj prijelaz je fizički proces promjene stanja koji ne uključuje kemijske reakcije.
Obrnuti proces, tj. izravan prijelaz iz plinovite faze u krutu fazu, naziva se različito. Neki autori za ovu faznu promjenu zadržavaju riječ sublimacija, dok drugi koriste "resublimacija", pa čak i "taloženje".
Kako funkcionira sublimacija
Može se povući paralela između sublimacije i isparavanja. U oba slučaja krajnja točka je plinovita faza. Razlika je, očito, u početnoj fazi: čvrsta za sublimaciju i tekuća za isparavanje.
U oba slučaja, postoji utjecaj pritiska devapor i također termodinamički aspekti, koji uključuju toplinu i međumolekulske interakcije.
Što je tlak pare?
U zatvorenom spremniku koji sadrži tekućinu moguće je uočiti da postoji ravnoteža između tekuće faze i faze pare. To se događa jer je, čak i ispod temperature vrenja, prisutna energija dovoljna da se neke molekule tekućine odvoje i prijeđu u paru. Međutim, neke molekule pare mogu se ponovno kondenzirati i vratiti u tekuću fazu, što pokazuje reverzibilnost procesa.
Ova para, napravljena od tvar (ima masu i volumen), vježbe pritisak na površinu tekućine, poznat kao tlak pare. Ne ovisi o količini tekućine, već o temperaturi, jer što je viša temperatura, to se molekule lakše odvajaju od tekuće faze.
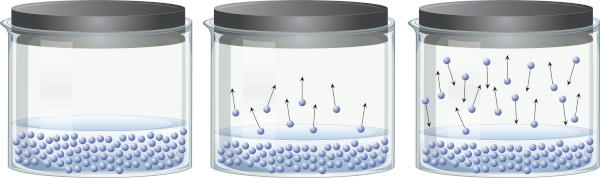
Tekućine koje imaju visok tlak pare pri uobičajenim temperaturama nazivaju se hlapljive. Na primjer, na 25°C, etil eter ima tlak pare od 0,58 atm, aceton (propanon) ima tlak pare od 0,29 atm, dok voda ima tlak pare od 0,023 atm. Usput, kada je tlak pare identičan atmosferskom tlaku, tekućina vrije. Da biste saznali više o tlaku pare, kliknite ovdje.
Tlak pare i sublimacija
Iako u manjoj mjeri, krute tvari također imaju tlak pare, ali mnogo niže nego kod tekućina. Na primjer, čak i pri temperaturi od 1000 K, tlak pare željeza je samo 9,21 x 10-20 bankomat. Međutim, neke krutine uspijevaju proći sublimaciju, kao što je jod, predstavljajući viši tlak pare na normalnim temperaturama (4 x 10-4 bankomat).
To je moguće samo prijelazom molekula iz krutog stanja izravno u plinovito stanje. Da bi se ovo dogodilo, molekule krutine moraju biti prisutne međumolekularne interakcije slab (u jodu, na primjer, oni su inducirani dipol-inducirani dipol tipa).
Također se vidi da proces sublimacije je endoterman, odnosno postoji potreba da molekule krutine apsorbiraju energiju u obliku topline kako bi mogle prekinuti međumolekulske interakcije i prijeći u parovito stanje. Količina uključene topline može se izmjeriti termodinamičkom veličinom poznatom kao entalpija sublimacije.
Dijagram faza
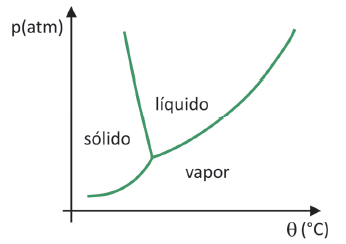
Do znati u kojem području tlaka i temperature će doći do sublimacije čvrste tvari, trebate procijeniti svoj fazni dijagram. Pogledajmo slučaj ugljičnog dioksida, CO2.

U faznom dijagramu, granične linije između stanja (kruto, tekuće i plinovito) spajaju vrijednosti tlaka i temperature za dolazi do promjene stanja. Promatrajući slučaj CO2, uočava se da pri tlaku od 1 atmosfere kruta faza prelazi izravno u parnu fazu na temperaturi od -78,5 °C, što karakterizira sublimaciju.
Ugljični dioksid ima samo tekuću fazu pri tlaku iznad 5,11 atmosfera, a iznad tog tlaka sublimacija više nije moguća. Da biste saznali više o faznom dijagramu, kliknite ovdje.
primjeri sublimacije
Suhi led: suhi led, koji se često koristi za stvaranje efekata magle na zabavama i događanjima, zapravo je ugljični dioksid u čvrstom stanju.

naftalin: naftalin se pravi od naftalina, aromatičnog organskog spoja. Primjenjuje se za uklanjanje neugodnih mirisa, ali i za plašenje moljaca, žohara i drugih otrovnica, zbog čega se često koriste u ormarima ili čak pisoarima.

Kamfor: S karakterističnim mirisom kamenčići kamfora također se mogu podvrgnuti sublimaciji. Također služe za tjeranje komaraca i sprječavanje plijesni.

Jod: nemetal koji pripada halogenima također prolazi sublimaciju.

Međutim, među predstavljenim tvarima, samo ugljikov dioksid podliježe sublimaciji u uvjetima okoline. Ostali, čak i uz sublimaciju, mogu proći normalnu fuziju pod pritiskom u kojem živimo.
Pročitajte također: Plazma — četvrto agregatno stanje
Riješene vježbe o sublimaciji
Pitanje 1
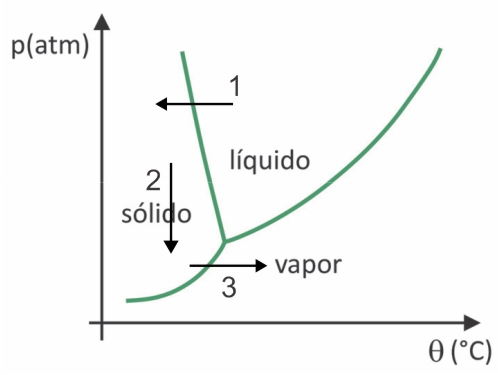
(Fuvest 2020) U supermarketima je uobičajeno pronaći takozvanu liofiliziranu hranu, poput voća, povrća i mesa. Liofilizirana hrana prikladna je za konzumaciju nakon dugo vremena, čak i bez hlađenja. Izraz "liofilizirano" u ovoj hrani odnosi se na proces zamrzavanja i naknadnu dehidraciju sublimacijom vode. Da bi došlo do sublimacije vode, potrebna je kombinacija uvjeta, kao što je prikazano na grafikonu tlak-temperatura, gdje linije predstavljaju fazne prijelaze.
Unatoč tome što je to proces koji zahtijeva, industrijski, upotrebu određene tehnologije, postoje dokazi da ljudi pretkolumbijci koji su živjeli u najvišim predjelima Anda mogli su sušiti hranu smrzavanjem, što je omogućilo njezino skladištenje za više vremena. Provjerite alternativu koja objašnjava kako je došlo do prirodnog procesa sušenja smrzavanjem:
a) Do sublimacije vode došlo je zbog niskih temperatura i visokog atmosferskog tlaka u planinama.
b) Hrana je nakon prirodnog smrzavanja u hladnim razdobljima odvožena u najniži dio planina, gdje je niži atmosferski tlak, što je omogućilo sublimaciju.
c) Hrana je bila izložena suncu kako bi se povećala temperatura, a niski lokalni atmosferski tlak pogodovao je skrućivanju.
d) Temperature su u hladnim razdobljima bile dovoljno niske za zamrzavanje hrane, a nizak atmosferski tlak u visokim planinama omogućio je sublimaciju.
e) Hrana je, nakon prirodnog zamrzavanja, pritisnuta da bi se povećao pritisak, kako bi došlo do sublimacije.
Odgovor: Slovo D.
U liofilizaciji dolazi do smrzavanja vode s naknadnom sublimacijom. Pretkolumbovski narodi mogli su provesti takav proces, jer se zimi voda mogla smrznuti (strelica 1) i, uz niske tlakove (strelica 2) najviših područja Anda, mogla bi doživjeti sublimaciju (strelica 3).
pitanje 2
(Uerj 2005.) Suhi led ili skrutnuti ugljični dioksid, široko korišten u rashladnim procesima, podvrgava se sublimaciji u okolnim uvjetima. Tijekom te transformacije, između ostalog, dolazi do fenomena varijacije energije i poremećaja međudjelovanja.
Ti se fenomeni klasificiraju, redom, kao:
a) egzotermni – interionski
b) egzotermne – internuklearne
c) izotermni – međuatomski
d) endotermni – intermolekulski
Odgovor: Slovo D.
Sublimacija je endoterman proces, budući da zahtijeva apsorpciju topline kako bi se prekinule interakcije koje održavaju kompaktnost molekula krute faze. Ove interakcije su intermolekularnog tipa.
Autor Stefano Araujo Novais
Profesor kemije
