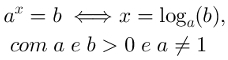Jedan polarni spoj (ili tvar) je onaj koji ima dvije regije s različitim gustoćama elektrona. Jedna od ovih regija ima pozitivan karakter (bijelo područje), a druga ima negativan karakter (žuto područje), kao što možemo vidjeti u sljedećem prikazu:

Prikaz područja različitog naboja u polarnom spoju
Znati je li izvjesno kompozit je polaran podrazumijeva poznavanje vrste međumolekularne sile koja pogoduje interakciji između njezinih molekula ili s molekule drugih tvari, kao i stvaranje pretpostavki o njihovoj topljivosti i točkama taljenja i ključanje.
Na primjer: s obzirom na topljivost, polarni spojevi imaju dobru sposobnost otapanja u polarne spojeve. Što se tiče međumolekularnih sila, ovisno o slučaju, polarni spojevi mogu međusobno djelovati silama trajne dipolne ili vodikove veze (snaga koja također rezultira višim točkama taljenja i ključanje).
Evo dva praktična načina da odredite je li spoj polarni ili ne.
Određivanje polariteta kroz broj oblaka i broj liganada
Možemo utvrditi je li a kompozit je polaran
odnosom između broja jednakih atoma vezanih za središnji atom i broja elektronskih oblaka u tom središnjem atomu.Bilješka: Elektronski oblak je svaka kemijska veza između dva atoma ili par elektrona iz valentne ljuske atoma koji ne sudjeluju u vezi.
Ako je broj oblaka prisutnih u središnjem atomu različit od broja jednakih liganada u tom središnjem atomu, imamo polarni spoj. Da biste bolje razumjeli, slijedite primjere u nastavku:
1. primjer: Molekula cijanovodonične kiseline

Strukturna formula cijanovodične kiseline
U cijanovodičnoj kiselini središnji atom je ugljik, koji u sebi ima četiri elektrona valentni sloj za pripadnost IVA obitelji periodnog sustava. Kako ugljik stvara jednostruku vezu (dijeleći dva elektrona, s jednim elektronom iz svakog atoma uključeni) s vodikom i trostrukom vezom s dušikom, tako da u atomu nema elektrona koji ne vežu središnji.
Dakle, u cijanovodičnoj kiselini postoje dva elektronska oblaka (jednostruka i trostruka veza) i ligand koji je jednak drugom. Stoga je a polarni spoj.
2. primjer: Molekula amonijaka (NH3)

Strukturna formula amonijaka
U amonijaku, središnji atom je dušik, koji ima pet elektrona u svojoj valentnoj ljusci jer pripada VA obitelji periodnog sustava. Kako dušik stvara jednostruku vezu (dijeli dva elektrona, s jednim elektronom od svaki uključeni atom) sa svakim atomom vodika dva od njegovih pet elektrona ne sudjeluju u vezama.

Elektroni koji ne vežu dušik u amonijaku
Dakle, u amonijaku postoje četiri elektronska oblaka (tri jednostruke veze i nevezujući elektronski par) i tri jednaka liganda (tri vodika). Dakle, to je a polarni spoj.
Nemoj sada stati... Ima još toga nakon reklame ;)
Određivanje polariteta kroz vektor dipolnog momenta spoja
Možemo utvrditi je li a kompozit je polaran analizom rezultirajući vektor dipolnog momenta u svojoj strukturnoj formuli, uzimajući u obzir njezinu molekularna geometrija i razlika od elektronegativnost između uključenih atoma.
Bilješka: Silazni red elektronegativnosti elemenata: F > O > N > Cl > Br > I > S > C > P > H.
Kada je zbroj vektora prisutnih u molekuli različit od nule, spoj će biti polarni. Da biste bolje razumjeli, slijedite sljedeće primjere:
1. primjer: molekula triklorometana
Triklorometan je spoj koji predstavlja tetraedarska geometrija, kao što možemo vidjeti u njegovoj strukturnoj formuli u nastavku:

Strukturna formula triklorometana
Da bismo saznali radi li se o polarnom spoju ili ne, moramo prvo postaviti vektore dipolnog momenta (strelice koje pokazuju koji je atom stabilniji od drugog) u strukturni, kao u sljedećem primjeru:
Bilješka: Klor je elektronegativniji element od ugljika. Zauzvrat, ugljik je elektronegativniji element od vodika.

Vektori dipolnog momenta u triklorometanu
Vektori u ružičastoj mogu biti predstavljeni s +x i -x, jer imaju isti smjer (okomito) i suprotne smjerove (gore i dolje). Vektori u crvenoj su predstavljeni sa +x, jer imaju isti smjer i isti smjer. Dakle, rezultirajući vektor dipolnog momenta (zbroj vektora) je predstavljen sa:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Budući da je rezultirajući vektor dipolnog momenta različit od nule, imamo a polarni spoj.
2. primjer: molekula vode
Voda je spoj koji predstavlja kutna geometrija, kao što možemo vidjeti u njegovoj strukturnoj formuli u nastavku:

Strukturna formula vode
Da bismo saznali je li to polarni spoj ili ne, moramo prvo postaviti vektore dipolnog momenta (strelice koje pokazuju koji je atom stabilniji od drugog) u strukturu, kao što je prikazano u nastavku:
Bilješka: Kisik je elektronegativniji element od vodika.

vektori dipolnog momenta u vodi
Budući da su dva vektora u strukturi vode dijagonalno, moramo koristiti pravilo paralelograma. U ovom pravilu, kada povezujemo baze vektora, imamo stvaranje rezultirajućeg vektora (koji zamjenjuje dva prethodno korištena), kao u sljedećem modelu:

Rezultirajući vektor u strukturnoj formuli vode
Kako molekula vode ima jedan vektor, rezultirajući vektor dipolnog momenta nije jednak nuli, odnosno imamo polarni spoj.
Od mene Diogo Lopes Dias
Želite li referencirati ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Što je polarni spoj?"; Brazilska škola. Dostupno u: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm. Pristupljeno 27. srpnja 2021.