Nitrati su anorganski spojevi koji sadrže anion NO3-.
Dušik je obitelj 15, ima 5 elektrona u valentnoj ljusci i treba napraviti tri kovalentne veze (sa dijeljenim elektronima) imati osam elektrona u valentnoj ljusci i tako imati stabilan. Međutim, svaki kisik ima 6 elektrona u posljednjoj ljusci i stoga svaki njegov atom treba napraviti dvije veze da bi bio stabilan.
Dakle, u nitrat anionu, dušik je središnji element, koji čini dvostruku vezu s jednim od kisika, koji je stabilan, jednostruka veza s jednim od druga dva kisika, a s drugim kovalentna veza dativ. To znači da jedan od kisika nije stabilan, da treba primiti još 1 elektron, što daje ukupni naboj jednak -1. S dativnim dušikom čini vezu više nego što bi mogao, donirajući jedan od svojih elektrona, dobivajući naboj jednak +1. U nastavku pogledajte strukturu ovog aniona:
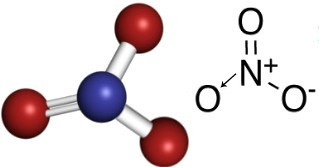
Ovaj anion može primiti elektron i formirati električni neutralni spoj, anorgansku sol. Svi su ti spojevi topljivi u vodi.
Glavne primjene nitrata su u lijekovima, kao što su vazodilatatori u liječenju angine pektoris (bol u uzrokovano slabom opskrbom kisikom protokom krvi u srčani mišić) i erektilna disfunkcija muški. Također se koriste u gnojivima i eksplozivima, kao što će biti spomenuto kasnije.
Nitrati se mogu proizvesti reakcijom neutralizacije dušične kiseline (HNO).3) s nekom osnovom. Pogledajte primjer u nastavku gdje je nastao magnezijev nitrat:
HNO3 + Mg(OH)2 → Mg (BR3)2+ H2O
Tri glavna primjera ove vrste spojeva su natrijev nitrat (NaNO3), kalijev nitrat (KNO3) i amonijev nitrat (NH4NA3). U svim tim slučajevima kationi (Na+,K+ i NH4+) daju 1 elektron nitratnom anionu. Ali, u stvarnosti, ti suprotni naboji se međusobno privlače i tvore dobro definirane ionske klastere, a to su kristalne rešetke. Dakle, nitrati su obično kristalne krutine, kao što je prikazano u nastavku u slučaju natrijevog nitrata:
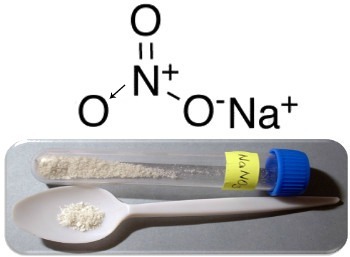
Ovaj spoj se koristi u proizvodnji gnojiva, ali je uglavnom poznat kao Čileanska salitra, budući da postoje njegova velika ležišta u čileanskim pustinjama. Pretvara se u kalijev nitrat, koji se koristi za izradu crnog baruta koji se koristi u raznim oružjima i eksplozivima.

I natrijev nitrat i kalijev nitrat nazivaju se "solitra" i naširoko se koriste kao konzervansi boje konzerviranog i dimljenog mesa, kao i u nekim namirnicama za davanje većeg osjećaja sitost. Međutim, njegova konzumacija uzrokuje ozbiljne štete po zdravlje, jer se ti nitrati mogu transformirati bakterijama iz organizam u nitrite, a kasnije i u nitrozamine, koji su kancerogeni i uglavnom uzrokuju rak u trbuh. Nitriti također pretvaraju hemoglobine u krvi, čineći ih nesposobnim prenositi kisik.
Glavni uzroci prekomjernog unosa nitrata su uporaba dušičnih gnojiva u uzgoju povrća.
Saltitra je također opasna jer povećava koncentraciju natrijevih iona u tijelu, što može uzrokovati srčane probleme poput visokog krvnog tlaka.
O amonijev nitrat koristi se i kao gnojivo i eksploziv, a čak je korišten i s loživim uljem u terorističkom napadu na zgrade Svjetskog trgovinskog centra 11. rujna 2001. godine.

U napadu na Svjetski trgovinski centar korišten je amonijev nitrat*
* Autorska prava slike: Dan Howell i Shutterstock.com
Autora Jennifer Fogaça
Diplomirao kemiju

