Na reakcije izgaranja prisutni su u mnogim aspektima našeg svakodnevnog života. Na primjer, glavni izvori proizvodnje energije proizlaze iz izgaranja ili izgaranja određenih goriva, kao što su etanol, benzin, drveni ugljen, između ostalih. Nadalje, energija koja nam je potrebna za preživljavanje i obavljanje posla rezultat je reakcija izgaranja koje se odvijaju unutar naših stanica kada "sagorimo" hranu koju jedemo.
Ali što je potrebno za reakciju izgaranja?
Potrebne su tri stvari:
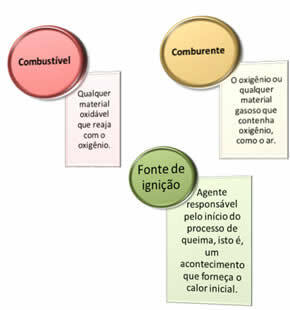
Ova tri faktora čine vatreni trokut, jer kada započne reakcija izgaranja, oslobođena energija održava reakciju i omogućuje joj da se nastavi sve dok gorivo, oksidant ili toplina (oslobođena energija) ne nestanu. To znači da će postojati a Lančana reakcija.
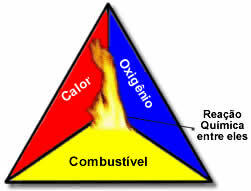
Na primjer, ako netko baci upaljenu cigaretu u šumi, doći će do požara (reakcija izgaranja). U ovom slučaju, Grm to je gorivo, O kisik prisutan u zraku atmosferski je oksidant to je cigareta osvijetljen je bio izvor paljenja. Ovo izgaranje će se nastaviti sve dok se ne eliminira jedan od tri čimbenika. Ako vatrogasci bace vodu, toplina će biti eliminirana. Ali čak i ako se ništa ne učini da se to gorenje zaustavi, ono će kad-tad prestati, odnosno kad ponestane goriva (šume).
Kao što je već spomenuto, u tim reakcijama se oslobađa toplina, pa je izgaranje egzotermna reakcija. Međutim, ova vrsta reakcije je nepotpuno izgaranje. Da biste razumjeli zašto, pogledajte razliku između potpunog i nepotpunog izgaranja:
Potpuno izgaranje:
Analizirajući organske spojeve kao goriva, moramo:
| THE potpuno izgaranje to će se dogoditi kada se ugljični lanac prekine i svi atomi ugljika u lancu ugljika budu potpuno oksidirani. |
| Vas formirani proizvodi ugljikovodici će biti CO2 (ugljični dioksid) i H2O (Voda). |
Promatrajte potpuno izgaranje izooktana, koji je jedan od sastojaka benzina.
Ç8H18 (g) +25/2 O2 (g) → 8 CO2 (g) + 9 sati2O(1)
nepotpuno izgaranje
| U ovom slučaju nema dovoljno oksidatora, odnosno dovoljno kisika da izgori svo gorivo. |
| Dakle, nastali proizvodi su CO (ugljični monoksid) i H2O. |
Promatrajte isto izgaranje izoktana, međutim, sada nepotpuno:
Ç8H18 (g) + 17/2 O2(g) → 8 CO (g) + 9 sati2O(1)
Primjer je spaljivanje šuma, budući da se rezultirajuće emisije sastoje od CO i određene tvari, poput čađe (C), kao i pepela i drugih jednostavnih i složenih organskih spojeva. Dušikov oksid, ozon i aldehidi također mogu nastati kao rezultat sekundarnih reakcija zbog prisutnosti drugih komponenti u zraku.
Ç8H18 (g) + 9/2 O2 (g) → 8C (g) + 9 sati2O(1)
Autora Jennifer Fogaça
Diplomirao kemiju
Školski tim Brazila
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

