Anorganske funkcije su skupine anorganskih spojeva koji imaju slična svojstva.
Temeljna klasifikacija u odnosu na kemijske spojeve je: organski spojevi su oni koji sadrže atome ugljika, dok organski spojevi sadrže atome ugljika. anorganski spojevi tvore ih ostali kemijski elementi.
Postoje iznimke poput CO, CO2 i dalje2CO3, koji unatoč tome što imaju ugljik u strukturnoj formuli, imaju svojstva anorganskih tvari.
Četiri glavne anorganske funkcije su: kiseline, baze, soli i oksidi.
Ove 4 glavne funkcije definirao je Arrhenius, kemičar koji je identificirao ione u kiselinama, bazama i solima.
Kiseline
Kiseline oni su kovalentni spojevi, odnosno dijele elektrone u svojim vezama. Imaju sposobnost ioniziranja u vodi i stvaranja naboja oslobađajući H+ kao jedini kation.
Klasifikacija kiselina
Kiseline se mogu klasificirati prema količini vodika koja se ispušta u vodenu otopinu i ionizira reagirajući s vodom dajući hidronijev ion.
| Broj ionizirajućih vodika |
|---|
|
Monokiseline: imaju samo jedan ionizirajući vodik. Primjeri: HNO3, HCl i HCN |
|
dijacidne kiseline: imaju dva vodika koji se mogu ionizirati. Primjeri: H2SAMO4, H2S i H2MnO4 |
|
Triacidi: imaju tri vodika koji se mogu ionizirati. Primjeri: H3PRAH4 i H3BO3 |
|
tetracidi: imaju četiri vodika koji se mogu ionizirati. Primjeri: H4Str7O7 |
Jačina kiseline mjeri se stupnjem ionizacije. Što je veća vrijednost jača je kiselina jer:
| stupanj ionizacije |
|---|
|
jaka: imaju stupanj ionizacije veći od 50%. |
|
umjereno: imaju stupanj ionizacije između 5% i 50%. |
|
slab: imaju stupanj ionizacije ispod 5%. |
Kiseline mogu, ali i ne moraju sadržavati element kisik u svojoj strukturi, tako da:
| prisutnost kisika |
|---|
|
Hidracidi: nemaju atome kisika. Primjeri: HCl, HBr i HCN. |
|
oksiakiseline: Element kisik prisutan je u kiseloj strukturi. Primjeri: HClO, H2CO3 i HNO3. |
Nomenklatura kiselina
Opća formula kiseline može se opisati kao HxTHE, gdje A predstavlja anion koji tvori kiselinu, a generirana nomenklatura može biti:
| završetak aniona | Prestanak kiseline |
|---|---|
|
eto Primjer: klorid (Cl-) |
hidrični Primjer: klorovodična kiselina (HCl) |
|
djelovati Primjer: klorat |
ich Primjer: klorovodična kiselina (HClO3) |
|
vrlo Primjer: nitrit |
kost Primjer: dušična kiselina (HNO2) |
Karakteristike kiselina
Glavne karakteristike kiselina su:
- Kiselog su okusa.
- Oni nose električnu struju, jer su elektrolitska otopina.
- Oni stvaraju plinoviti vodik kada reagiraju s metalima poput magnezija i cinka.
- Oblikujte ugljični dioksid u reakciji s kalcijevim karbonatom.
- Oni mijenjaju kiselinsko-bazne pokazatelje u određenu boju (plavi lakmus papir postaje crven).
Glavne kiseline
Primjeri: klorovodična kiselina (HCl), sumporna kiselina (H2SAMO4), octena kiselina (CH3COOH), ugljična kiselina (H2CO3) i dušična kiselina (HNO3).

Iako je octena kiselina kiselina iz organske kemije, važno je znati njezinu strukturu zbog njene važnosti.
Baze
Baze su ionski spojevi nastali kationima, uglavnom metalima, koji se disociraju u vodi oslobađajući hidroksid anion (OH-).
Osnovna klasifikacija
Baze se mogu klasificirati prema broju hidroksila oslobođenih u otopini.
| Broj hidroksila |
|---|
|
Monobaze: imaju samo jedan hidroksil. Primjeri: NaOH, KOH i NH4Oh |
|
Dibaze: imaju dva hidroksila. Primjeri: Ca (OH)2, Fe (OH)2 i Mg (OH)2 |
|
Tribaze: imaju tri hidroksila. Primjeri: Al (OH)3 i Fe (OH)3 |
|
tetrabaze: imaju četiri hidroksila. Primjeri: Sn (OH)4 i Pb (OH)4 |
Baze su općenito ionske tvari i snaga baze mjeri se stupnjem disocijacije.
Što je veća vrijednost jača je baza jer:
| stupanj disocijacije |
|---|
|
jaka: imaju stupanj disocijacije praktički 100%. Primjeri:
|
|
slab: imaju stupanj disocijacije ispod 5%. Primjer: NH4OH i Zn (OH)2. |
| Topljivost u vodi |
|---|
|
Topljiv: baze alkalijskih metala i amonijaka. Primjeri: Ca (OH)2, Ba (OH)2 i NH4Oh. |
|
Malo topiv: baze zemnoalkalijskih metala. Primjeri: Ca (OH)2 i Ba (OH)2. |
|
praktički netopiv: ostale baze. Primjeri: AgOH i Al (OH)3. |
Osnovna nomenklatura
Opća formula baze može se opisati kao , gdje B predstavlja pozitivni radikal koji tvori bazu, a y naboj koji određuje broj hidroksila.
Nomenklatura baza s fiksnim opterećenjem dana je:
| Baze s fiksnim opterećenjem | ||
|---|---|---|
alkalni metali |
litijev hidroksid |
LiOH |
| Zemnoalkalijski metali | magnezijev hidroksid |
Mg (OH)2 |
Srebro |
srebrni hidroksid |
AgOH |
| Cinkov | cink hidroksid | Zn (OH)2 |
| Aluminij | aluminij hidroksid | Al (OH)3 |
Kada baza ima promjenjivo opterećenje, nomenklatura može biti na dva načina:
| Baze s promjenjivim opterećenjem | |||
|---|---|---|---|
| Bakar | Dupe+ | bakarni hidroksid I | CuOH |
| bakreni hidroksid | |||
| Dupe2+ | bakar hidroksid II | Cu (OH)2 | |
| bakarni hidroksid | |||
| Željezo | Vjera2+ | Željezni hidroksid II | Fe (OH)2 |
| željezni hidroksid | |||
| Vjera3+ | Željezni hidroksid III | Fe (OH)3 | |
| željezni hidroksid |
Karakteristike baza
- Većina baza je netopiva u vodi.
- Provoditi električnu struju u vodenoj otopini.
- Skliske su.
- Oni reagiraju s kiselinom stvarajući sol i vodu kao proizvode.
- Oni mijenjaju kiselinsko-bazne pokazatelje u određenu boju (crveni lakmus papir postaje plav).
Glavne baze
Baze se široko koriste u proizvodima za čišćenje i također u procesima kemijske industrije.
Primjeri: natrijev hidroksid (NaOH), magnezijev hidroksid (Mg (OH)2), amonijev hidroksid (NH4OH), aluminij hidroksid (Al (OH)3) i kalcijev hidroksid (Ca (OH)2).

soli
soli su jonski spojevi koji imaju barem jedan kation osim H+ i anion koji nije OH-.
Sol se može dobiti u reakciji neutralizacije, koja je reakcija između kiseline i baze.
Reakcijom klorovodične kiseline s natrijevim hidroksidom nastaju natrijev klorid i voda.
Nastala sol sastoji se od kiselinskog aniona (Cl-) i osnovnim kationom (Na+).
Klasifikacija soli
U nastavku imamo glavne obitelji soli koje se mogu klasificirati prema topljivosti u vodi i promjeni pH otopine kako slijedi:
| Topljivost u vodi najčešćih soli | |||
|---|---|---|---|
| Topljiv | Nitrati | Iznimke: Srebrni acetat. |
|
| Klorati | |||
Acetati |
|||
| Kloridi | Iznimke: |
||
| Bromidi | |||
| Jodidi | |||
| Sulfati |
Iznimke: |
||
| Netopljiv | Sulfidi |
Iznimke: zemnoalkalna zemlja i amonij. |
|
| Karbonati | Iznimke: Oni od alkalnih metala i amonijaka. |
||
| Fosfati |
| pH | |
|---|---|
| neutralne soli |
Kad se otope u vodi, ne mijenjaju pH. Primjer: NaCl. |
| kiselinske soli |
Kad se otope u vodi, čine otopinu pH manjom od 7. Primjer: NH4Kl. |
| osnovne soli |
Kada su otopljeni u vodi, pH otopine postaje veći od 7. Primjer: CH3COONa. |
Uz obitelji soli koje smo ranije vidjeli, postoje i druge vrste soli, kao što je prikazano u donjoj tablici.
| Ostale vrste soli | |
|---|---|
| vodikove soli | Primjer: NaHCO3 |
| Hidroksi-soli | Primjer: Al (OH)2Kl |
| dvostruke soli | Primjer: KNaSO4 |
| hidratirane soli | Primjer: CuSO4. 5 sati2O |
| složene soli | Primjer: [Cu (NH3)4]SAMO4 |
Nomenklatura soli
Općenito, nomenklatura soli slijedi sljedeći redoslijed:
| naziv aniona | naziv kationa | ime soli |
|---|---|---|
|
Kl- Klorid |
Vjera3+ Željezo III |
FeCl3 Željezni klorid III |
|
Sulfat |
Na+ Natrij |
Na2SAMO4 Natrijev sulfat |
|
Nitrit |
K+ Kalij |
KNO2 Kalijev nitrit |
|
br- Bromid |
Ovdje2+ Kalcij |
CaBr2 kalcijev bromid |
Karakteristike soli
- Oni su jonski spojevi.
- Oni su čvrsti i kristalni.
- Patite od vrenja na visokim temperaturama.
- Provoditi električnu struju u otopini.
- Imaju slani okus.
Glavne soli
Primjeri: kalijev nitrat (KNO3), natrijev hipoklorit (NaClO), natrijev fluorid (NaF), natrijev karbonat (Na2CO3) i kalcijev sulfat (CaSO4).

Oksidi
Oksidi su binarni spojevi (ionski ili molekularni) koji imaju dva elementa. U svom sastavu imaju kisik, koji je njihov najelektronegativniji element.
Opća formula za oksid je , gdje je C kation i njegov naboj y postaje indeks u oksidu koji tvori spoj:
Klasifikacija oksida
| Prema kemijskim vezama | |
|---|---|
| Jonski |
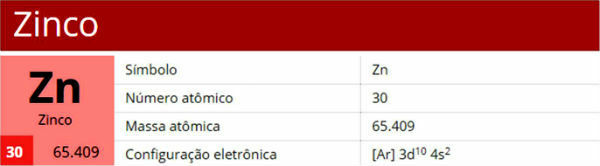
Kombinacija kisika s metalima. Primjer: ZnO. |
| Molekularni |
Kombinacija kisika s nemetalnim elementima. Primjer: OS2. |
| Prema svojstvima | |
|---|---|
| Osnove |
U vodenoj otopini mijenjaju pH na veći od 7. Primjer: Čitam2O (i ostali alkalijski i zemnoalkalijski metali). |
| Kiseline |
U vodenoj otopini reagiraju s vodom i stvaraju kiseline. Primjeri: CO2, SAMO3 i NE2. |
| Neutralni |
Neki oksidi koji ne reagiraju s vodom. Primjer: CO. |
| Peroksidi |
U vodenoj otopini reagiraju s vodom ili razrijeđenim kiselinama i tvore vodikov peroksid H2O2. Primjer: Na2O2. |
| Pojačala |
Mogu se ponašati poput kiselina ili baza. Primjer: ZnO. |
Nomenklatura oksida
Općenito, nomenklatura oksida slijedi sljedeći redoslijed:
| Naziv prema vrsti oksida | |
|---|---|
| ionski oksidi |
Primjeri oksida s fiksnim nabojem: CaO - kalcijev oksid Al2O3 - aluminijev oksid |
|
Primjeri oksida s promjenjivim nabojem: FeO - željezov oksid II Vjera2O3 - Željezni oksid III | |
| molekularni oksidi |
Primjeri: CO - ugljični monoksid N2O5 - dušikov pentoksid |
Karakteristike oksida
- Oni su binarne tvari.
- Nastaju vezanjem kisika s drugim elementima, osim s fluorom.
- Metalni oksidi u reakciji s kiselinama tvore sol i vodu.
- Nemetalni oksidi u reakciji s bazama tvore sol i vodu.
Glavni oksidi
Primjeri: kalcijev oksid (CaO), manganov oksid (MnO2), kositreni oksid (SnO2), željezov oksid III (Fe2O3) i aluminijev oksid (Al2CO3).

Vježbe prijamnog ispita
1. (UEMA / 2015) BR2i OS2 su plinovi koji uzrokuju onečišćenje atmosfere koji, među nanesenom štetom, rezultiraju stvaranjem kisele kiše kada ti plinovi reagiraju s česticama vode prisutnim u oblacima, stvarajući HNO3 i H2SAMO4.
Ovi spojevi, kada se prenose atmosferskim oborinama, stvaraju smetnje, poput onečišćenja pitke vode, korozije vozila, povijesnih spomenika itd.
Anorganski spojevi spomenuti u tekstu odgovaraju funkcijama:
a) soli i oksidi
b) baze i soli
c) kiseline i baze
d) baze i oksidi
e) oksidi i kiseline
Ispravna alternativa: e) oksidi i kiseline.

Oksidi su spojevi nastali kisikom i drugim elementima, osim fluora.
Kiseline, kada dođu u kontakt s vodom, prolaze ionizaciju i stvaraju hidronijev ion. Za dotične kiseline imamo sljedeće reakcije:
HNO3 monokiselina je jer ima samo jedan ionizirajući vodik. Već H2SAMO4 to je kiselina jer ima dva vodika koji se mogu ionizirati.
Ostale anorganske funkcije prisutne u pitanjima odgovaraju:
Baze: hidroksilni ioni (OH-) ionski povezani s metalnim kationima.
Soli: produkt reakcije neutralizacije između kiseline i baze.
Nauči više okemijske funkcije.
2. (UNEMAT / 2012) U svakodnevnom životu koristimo razne kemijske proizvode, poput magnezijevog mlijeka, octa, vapnenca i kaustične sode.
Ispravno je tvrditi da spomenute tvari pripadaju kemijskim funkcijama:
a) kiselina, baza, sol i baza
b) baza, sol, kiselina i baza
c) baza, kiselina, sol i baza
d) kiselina, baza, baza i sol
e) sol, kiselina, sol i baza
Točna alternativa: c) baza, kiselina, sol i baza.
Magnezijevo mlijeko, vapnenac i kaustična soda primjeri su spojeva koji u svojim strukturama sadrže anorganske funkcije.
Ocat je organski spoj nastao slabom karboksilnom kiselinom.
U donjoj tablici možemo promatrati strukturu svakog od njih i kemijske funkcije koje ih karakteriziraju.
| Proizvod | Magnezijevo mlijeko | Ocat | Vapnenac | Kaustična soda |
|---|---|---|---|---|
| Kemijski kompost | magnezijev hidroksid | Octena kiselina | Kalcijev karbonat | Natrijev hidroksid |
| Formula | ||||
| kemijska funkcija | Baza | karboksilna kiselina | sol | Baza |
Magnezijevo mlijeko suspenzija je magnezijevog hidroksida koja se koristi za liječenje želučane kiseline jer reagira s klorovodičnom kiselinom iz želučanog soka.
Ocat je široko korišten začin uglavnom u pripremi hrane zbog svoje arome i okusa.
Vapnenac je sedimentna stijena čija je glavna ruda kalcit koji sadrži velike količine kalcijevog karbonata.
Kaustična soda je trgovački naziv za natrijev hidroksid, snažnu bazu koja se koristi u mnogim industrijskim procesima i u kućanstvu za odčepljivanje cijevi zbog nakupljanja ulja i masti.
3. (UDESC / 2008) Što se tiče solne kiseline, može se reći da:
a) kada je u vodenoj otopini, omogućuje prolazak električne struje
b) je kiselina
c) je slaba kiselina
d) ima nizak stupanj ionizacije
e) je ionska tvar
Ispravna alternativa: a) kada je u vodenoj otopini, omogućuje prolazak električne struje.
Klorovodična kiselina je monokiselina jer ima samo jedan vodik koji se može ionizirati.
To je molekularni spoj s visokim stupnjem ionizacije, pa je stoga jaka kiselina koja, kada uđe u ugovor s vodom, razbija svoju molekulu na ione kako slijedi:
Kao što je Arrhenius primijetio u svojim eksperimentima, pozitivni ioni nastali u ionizaciji kreću se prema negativnom polu, dok se negativni ioni kreću prema pozitivnom polu.
Na taj način u otopinu teče električna struja.
Za više problema s komentiranim rješavanjem, također pogledajte: vježbe o anorganskim funkcijama.