Elektroliza je fizikalno-kemijski postupak koji koristi električnu energiju iz bilo kojeg izvora (kao što je baterija ili baterija) prisiliti pojavu kemijske reakcije da proizvedu jednostavne ili složene tvari koje se u prirodi ne mogu naći ili ih nema u velikim količinama.
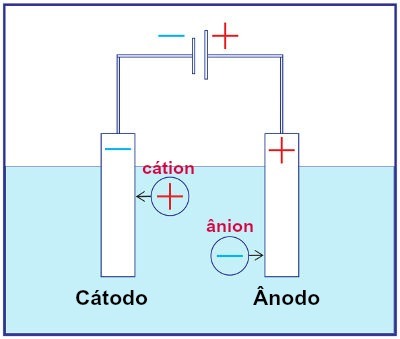
Prikaz sklopa bilo kojeg sustava za elektrolizu
Tijekom elektrolize, kation prolazi na redukciji na katodi, a anion na oksidaciji na anodi. To se događa kroz električno pražnjenje koje osigurava vanjski izvor. Dakle, u elektrolizi imamo nespontanu reakciju oksidacije i redukcije.
Sada shvatite dva načina na koja se elektroliza događa:
U ovoj vrsti elektrolize koristimo a ionska tvar u tekućem stanju u elektrolitskoj posudi. Kada se ionska tvar (XY) podvrgne fuziji, ona prolazi kroz proces disocijacija, kako je predstavljeno u nastavku:
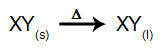

Zatim, kad je izvor napajanja uključen, kation (X+) kreće se prema katodi, a anioni (Y-) kretati se prema anodi. Time:
Na katodi: kationi primaju elektrone (oni se podvrgavaju redukciji) i transformiraju se u stabilnu tvar (X), postupak predstavljen sljedećom jednadžbom:
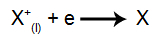
Na anodi: anioni gube elektrone (podvrgavaju se oksidaciji) i postaju stabilna tvar (X), postupak predstavljen sljedećom jednadžbom:

a) Primjer magmatske elektrolize
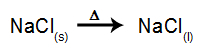
Kao primjer, slijedite sada magmatsku elektrolizu natrijev klorid (NaCl). Kada se natrijev klorid (NaCl) podvrgne fuziji, on prolazi kroz postupak disocijacije, kao što je prikazano dolje:
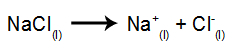
Zatim, kad je izvor napajanja uključen, kation (Na+) kreće se prema katodi, a anioni (Cl-) kretati se prema anodi. Time:
Na katodi: kationi u+ oni primaju elektrone (podvrgavaju se redukciji) i postaju stabilna tvar (Na, koji je čvrsti metal), proces predstavljen jednadžbom u nastavku:

Na anodi: anioni Cl- gube elektrone (podvrgavaju se oksidaciji) i postaju stabilna tvar (Cl2, koji je plinovit), postupak predstavljen jednadžbom u nastavku:

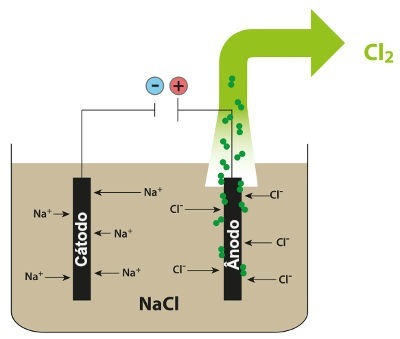
Shema koja prikazuje magmatsku elektrolizu NaCl
Dakle, u magmatskoj elektrolizi natrijevog klorida nastaje metalni natrij (Na) i plinoviti klor (Cl2).
U ovoj vrsti elektrolize koristimo ionsku tvar otopljenu u vodi, unutar elektrolitskog spremnika. Dakle, prije izvođenja elektrolize prvo pomiješamo tvar (obično sol anorganski) u vodi da uzrokuje njezinu disocijaciju (oslobađanje kationa i aniona), kao što je prikazano dolje:
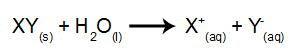
Razlika u odnosu na magmatsku elektrolizu je u tome što osim iona iz disocijacije imamo i ione iz samojonizacije vode. U svojoj samojonizaciji voda stvara hidronijev kation (H+) i hidroksid anion (OH-), kao u donjoj jednadžbi:

Dakle, unutar elektrolitske posude imamo dva kationa (jedan iz tvari ionski i jedan iz vode) i dva aniona (jedan iz ionske tvari, a drugi iz Voda).
Da bismo znali koji će se kation premjestiti na katodu, a koji anion na anodu, potrebno je znati redoslijed pražnjenja kationova i aniona.
Za katione:
Au> Pt> Hg> Ag> Cu> Ni> Cd> Pb> Fe> Zn> Mn> hidronij> IIIA obitelj> IIA obitelj> IA obitelj
za anione
Neoksigenirani anioni i HSO4 > hidroksid> oksigenirani anioni i F
Zatim, kad je izvor napajanja uključen, kation (X+) kreće se prema katodi, a jedan od aniona (Y-) kreće se prema anodi.
Na katodi: kationi primaju elektrone (oni se podvrgavaju redukciji) i transformiraju se u stabilnu tvar (X), proces predstavljen jednadžbom dolje:

Na anodi: anioni gube elektrone (podvrgavaju se oksidaciji) i pretvaraju se u stabilnu tvar (Y), postupak predstavljen jednadžbom dolje:
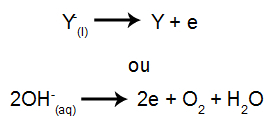
a) Primjer vodene elektrolize
Kao primjer koristit ćemo vodenu elektrolizu natrijevog klorida (NaCl). Kada se natrijev klorid (NaCl) otopi u vodi, on prolazi kroz postupak disocijacije, kao što je prikazano dolje:
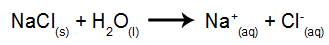
Uz disocijaciju NaCl, imamo i samojonizaciju vode:

Dakle, imamo H katione+ i dalje+ i OH anioni- i Cl-. Zatim, kada je izvor napajanja uključen, imamo sljedeće:
na katodi: H kationi+ primaju elektrone (reducirane) i postaju stabilna tvar (H2, koji je plin). To je zato što hidronij ima prednost ispuštanja nad elementima obitelji IA (u ovom slučaju Na). Postupak je predstavljen jednadžbom u nastavku:
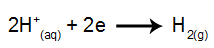
na anodi: Cl anioni- gube elektrone (podvrgavaju se oksidaciji) i postaju stabilna tvar (Cl2, koji je plinovit). To je zato što Cl- to je anoksificirani anion i ima prednost ispuštanja u odnosu na hidroksid, postupak predstavljen jednadžbom u nastavku:


Shema koja prikazuje vodenu elektrolizu NaCl
Dakle, u vodenoj elektrolizi natrijevog klorida imamo stvaranje plinovitog vodika (H2) i plinoviti klor (Cl2).
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise.htm

