Eksperimenti su praktičan način da naučite i provjerite svoje znanje o pojmovima koji se proučavaju u kemiji.
Iskoristite ove kemijske eksperimente koji se mogu izvoditi kod kuće (pod nadzorom odrasle osobe) ili raditi u učionici s učiteljem da biste nadopunili vaš studij.
1. iskustvo - razotkrivanje boja
Uključeni pojmovi: kromatografija i odvajanje smjesa
Materijali
- olovke (označeni markeri) raznih boja
- alkohol
- filter papir za kavu
- šalica (čaša za olakšavanje praćenja pokusa)
Kako napraviti
- Upotrijebite škare i izrežite trake filtarskog papira. Za svaku upotrijebljenu olovku napravite pravokutnik.
- Sada, na udaljenosti od približno 2 cm od baze, olovkom u boji odaberite željenu boju i bojite svu unutrašnjost.
- Zalijepite rub papira najdalje od nacrtanog mramora na nosač. Za to možete upotrijebiti traku i pričvrstiti je na olovku.
- U šalicu dodajte alkohol, ne previše, jer bi trebao dodirivati kraj papira blizu oznake olovke.
- Stavite papir u šalicu tako da bude okomit. Olovka koja je podupire trebala bi se odmarati na rubovima.
- Pričekajte između 10 i 15 minuta da se alkohol digne kroz filter papir. Nakon toga uklonite papire i pustite da se osuše.
Proizlaziti
Kad alkohol prolazi kroz trag olovke, on stupa u interakciju s komponentama boje i vozi ih po papiru. Tako će se različiti pigmenti odvojiti kontaktom s alkoholom.
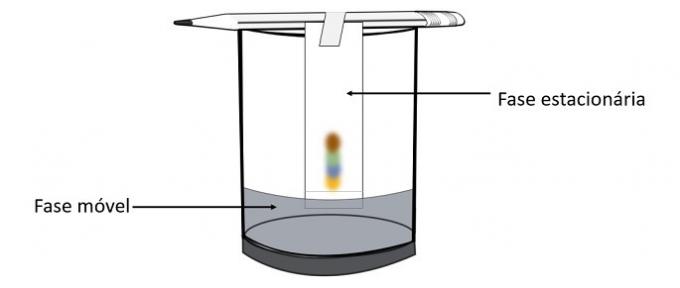
Kroz ovaj eksperiment moguće je znati koje su boje pomiješane da bi se stvorila boja olovke.
Obrazloženje
Kromatografija je vrsta postupka za odvajanje smjesa. Filter papir je stacionarna faza, a alkohol je pokretna faza koja vuče komponente smjese dok prolazi kroz stacionarnu fazu. U ovom procesu, što je veća interakcija s alkoholom, brže će se pigment pomicati s prolaskom otapala.
Sastavni dijelovi materijala, budući da imaju različita svojstva, komunicirat će s mobilnom fazom na različite načine, što se može primijetiti po različitim vremenima povlačenja u stacionarnoj fazi.
Nauči više o kromatografija.
2. iskustvo - konzerviranje hrane
Uključeni pojmovi: organski spojevi i kemijske reakcije
Materijali
- jabuka, banana ili kruška
- sok od limuna ili naranče
- Vitamin C tableta
Kako napraviti
- Odaberite jedno od tri ploda i izrežite ga na 3 jednaka dijela.
- Prvi će komad poslužiti kao usporedba s ostalima. Stoga mu nemojte ništa dodavati, samo ga ostavite izloženog zraku.
- U jedan od dijelova nakapajte sadržaj limuna ili naranče. Širite tako da cijela unutrašnjost ploda bude prekrivena sokom.
- U posljednjem dijelu rasporedite vitamin C, to može biti zdrobljena tableta, po cijeloj voćnoj pulpi.
- Pogledajte što se događa i usporedite rezultate.
Proizlaziti
Pulpa ploda koji je bio izložen zraku trebala bi brzo potamniti. Sok od limuna ili naranče i vitamin C, kemikalija koja se naziva askorbinska kiselina, trebali bi usporiti posmeđivanje ploda.

Obrazloženje
Kad presiječemo plod, njegove stanice oštećuju se oslobađajući enzime poput polifenol oksidaze, koji u kontakt s zrakom oksidira fenolne spojeve prisutne u hrani i uzrokuje enzimsko smeđe boje.
Da bi se spriječilo djelovanje kisika, koriste se konzervansi kao što je askorbinska kiselina, jer se oni poželjno oksidiraju umjesto fenolnih spojeva. Osim tablete vitamina C, askorbinska kiselina prisutna je i u prirodnim izvorima, poput citrusa, limuna i naranče, predloženo u eksperimentu.
Nauči više o oksidacija.
3. iskustvo - tko se brže smrzava?
Uključeni pojmovi: koligativna svojstva i krioskopija
Materijali
- dvije cijevi (koriste se za zabave)
- staklena zdjela
- stolna sol
- filtrirana voda
- led
- termometar
Kako napraviti
- U obje epruvete dodajte jednaku količinu filtrirane vode. Na primjer, 5 ml u svakoj epruveti.
- Dodajte kuhinjsku sol u jednu epruvetu i stavite identifikacijsku traku kako biste razlikovali koja je slana.
- Staklenu posudu napunite zdrobljenim ledom i dodajte malo soli.
- Stavite dvije cijevi istovremeno u led i gledajte što se događa.
- Zabilježite temperaturu smrzavanja za svaku situaciju.
Proizlaziti
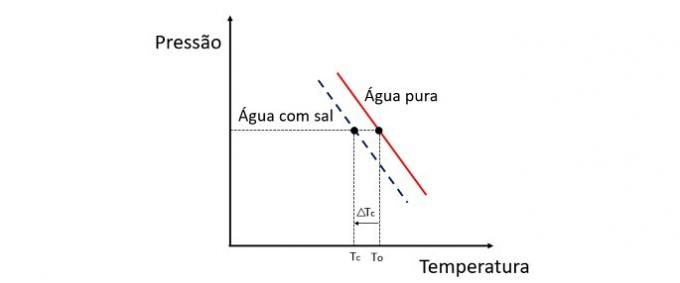
Dodavanjem otopljene tvari u vodu snižava se temperatura smrzavanja. Stoga obična voda ima tendenciju smrzavanja mnogo brže od otopine soli i vode kada je izložena istim uvjetima.
Obrazloženje
Krioskopija je koligativno svojstvo koje proučava varijaciju temperature otapala kada se u njemu otope različite količine otopljene tvari.
Snižavanje temperature smrzavanja vode uzrokovano je nehlapljivom otopljenom tvari i ovaj fenomen ima brojne praktične primjene. Stoga veća koncentracija otopljene tvari u otopini utječe na krioskopski učinak.
Ako se, na primjer, voda smrzne na 0 ° C i dodamo joj sol, temperatura promjene faze bit će negativna, tj. Puno niža.
Zbog toga se morska voda ne smrzava na mjestima čija je temperatura ispod 0 ° C. Sol otopljena u vodi teži daljnjem snižavanju temperature smrzavanja. Na mjestima gdje ima snijega, uobičajeno je i bacanje soli na ceste kako bi se led otopio i izbjegle nesreće.
Nauči više o koligativna svojstva.
4. pokus - razgradnja vodikovog peroksida
uključeni pojmovi: kemijska reakcija i katalizator
Materijali
- Pola sirovog krumpira, a pola kuhanog
- Komad sirove jetre i još jedan kuhani komad
- Vodikov peroksid
- 2 jela
Kako napraviti
- U svako jelo dodajte hranu, krumpir zajedno i jetra zajedno.
- U svaki od četiri materijala dodajte 3 kapi vodikovog peroksida.
- Pogledajte što se događa i usporedite rezultate.
Proizlaziti
Vodikov peroksid, otopina vodikovog peroksida, kada dođe u kontakt sa sirovom hranom, počinje bujati gotovo trenutno.
Ovaj se pokus također može izvesti dodavanjem komada hrane u posudu s vodikovim peroksidom kako bi reakcija bila uočljivija.
Obrazloženje
Šumeće koje predstavlja vodikov peroksid u dodiru sa sirovom hranom karakterizira pojava kemijske reakcije, koja je razgradnja vodikovog peroksida i oslobađanje plina kisik.
Razgradnja vodikovog peroksida događa se djelovanjem enzima katalaze, koji se nalazi u organelima peroksisoma, prisutnim u životinjskim i biljnim stanicama.
Važno je naglasiti da se razgradnja vodikovog peroksida događa spontano, u prisutnosti sunčeve svjetlosti, ali u vrlo sporoj reakciji. Međutim, katalaza djeluje kao katalizator, povećavajući brzinu kemijske reakcije.
Vodikov peroksid može biti otrovna tvar za stanice. Stoga katalaza razgrađuje spoj i stvara vodu i kisik, dvije tvari koje ne štete tijelu.
Kada se hrana kuha, njezini se sastojci podvrgnu promjenama. Modifikacije uzrokovane kuhanjem također ugrožavaju djelovanje katalaze denaturacijom proteina.
Ista akcija koju vidimo s hranom je ono što se događa kada na ranu stavimo vodikov peroksid. Katalaza djeluje i dolazi do stvaranja mjehurića, što se sastoji u oslobađanju kisika.
Nauči više o kemijske reakcije.
Bibliografske reference
SVETICI, W. L. P.; MOL, G. S. (Koordinate.). Citizen Kemija. 1. izd. São Paulo: Nova generacija, 2011 (monografija). v. 1, 2, 3.
BRAZILSKO KEMIJSKO DRUŠTVO (org.) 2010. Kemija u vašoj blizini: jeftini eksperimenti za učionicu K-12. 1. izd. Sao Paulo.