Može se dogoditi da postoje kiseline istog elementa, a taj element ima isti oksidacijski broj (NOX), ali razlika je u stupnjevima hidratacije.
Na primjer, dolje imamo tri kiseline koje tvori element fosfor (P):
H3PRAH4 H4Str2O7 HPO3
Imajte na umu da je u sve tri kiseline oksidacijski broj fosfora +5; razlika je u stupnju hidratacije.
Na temelju toga, ove se kiseline u nomenklaturi razlikuju putem predznaka orto, piro i meta.
Najviše hidratizirana kiselina naziva se orto. U navedenom primjeru, prvi (H3PRAH4) Zove se kiselina ortofosforna, jer je najhidriraniji od tri. Ortonski prefiks je potrošiv, tako da će se ova kiselina većinu vremena samo nazivati fosforna kiselina.
Prefiksi pyro i meta koriste se s orto kiselinom kao referentnom točkom:
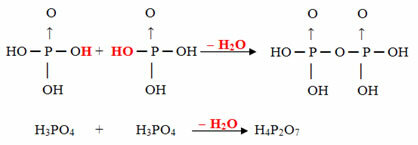
- Pirus: 2 molekule orto minus 1 molekula H2O
Primjer: H4Str2O7 Zove se kiselina pirofosforna jer je jednak dvjema molekulama ortofosforne kiseline (H3PRAH4) minus jedna molekula vode.
2. H3PRAH4 = H6Str2O8
H6Str2O8 - H2O = H4Str2O7
Ovaj postupak je intermolekularna dehidracija:
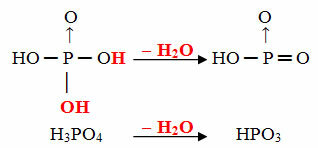
- Cilj: 1 molekula orto minus 1 molekula H2O
Primjer: HPO3 Zove se kiselina ciljfosforna jer je jednak molekuli ortofosforne kiseline (H3PRAH4) minus jedna molekula vode.
H3PRAH4 - H2O = HPO3
Ovaj postupak je intramolekularna dehidracija:
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/grau-hidratacao-dos-acidos.htm

