Prema modelu orbitala koji je stvorio Linus Pauling 1960., kovalentna veza koja tvori molekula nastaje fuzijom ili međusobnim prodiranjem nepotpunih orbitala elemenata koji sudjeluju u Veza. Stoga se zaključuje da ako element ima nepotpunu orbitalu (sa samo jednim elektronom), može stvoriti samo kovalentnu vezu. Ako ima dvije nepotpune orbitale, može uspostaviti najviše dvije veze i tako dalje.
Međutim, pogledajte atomske orbitale elementa atoma ugljika, koji ima atomski broj jednak 6 (Z = 6):
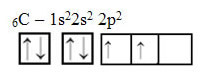
Imajte na umu da ima dvije nepotpune orbitale, pa bi trebao izvoditi najviše dva vezanja. Međutim, to mu se ne događa. Kao što mnogi znaju, ugljik stvara četiri veze (četverovalentni je), pa ovaj model orbitala ne objašnjava slučaj ugljika.
Da bi se okončao ovaj ćorsokak, stvorena je nova teorija koja je bolje objasnila ovo pitanje: Teorija hibridizacije.

To znači da je hibridizacija "mješavina" čistih orbitala.
Za ugljik postoje tri vrste hibridizacije, a to su: sp3, sp2 i sp.
Da bismo razumjeli kako dolazi do hibridizacije, pogledajmo prvi tip hibridizacije ugljika, tip sp.3:
Ova vrsta hibridizacije događa se u molekuli metana (CH4). Imajte na umu da postoje četiri identične kovalentne veze između ugljika, koji je središnji element, i četiri vodika. Pa, pogledajte što je nepotpuna vodikova orbitala:
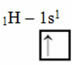
Kako svaki vodik ima nepotpunu orbitalu s-tipa, potrebno je primiti još jedan elektron, odnosno svaki stvara samo jednu kovalentnu vezu s ugljikom. Zato ugljik mora imati četiri nepotpune orbitale. Kako se to događa? Kroz hibridizaciju.
Kad elektron iz 2s orbitale upije energiju, on prelazi u praznu 2p orbitalu. Dakle, kažemo da je ovaj skok elektrona s 2 na 2p podnivo "promocija" elektrona. Na taj način ugljik ostaje u svom pobuđenom ili aktiviranom stanju, s četiri hibridizirane orbitale koje su na raspolaganju za provođenje kovalentnih veza:
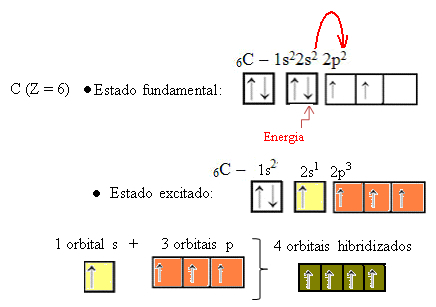
Imajte na umu da su formirane hibridne orbitale jednake jedna drugoj, ali različite od izvornih čistih orbitala.
Na taj se način javlja veza između s orbitale svakog od četiri atoma vodika s ove četiri hibridizirane ugljikove orbitale:
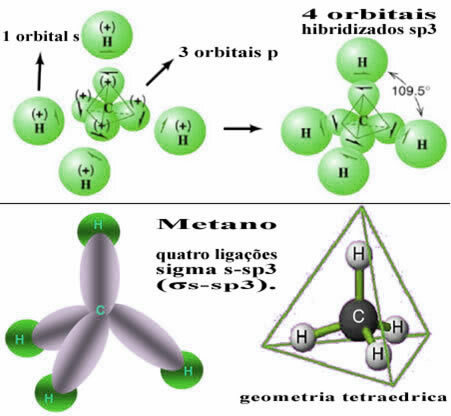
Kao što se vidi gore, molekula metana ima pravilnu strukturu tetraedra, s četiri oblaka elektrona u svakom vrhu i susjednim kutovima od 109 ° 28 ’. Budući da je veza napravljena između s orbitale svakog vodika i hibridizirane sp orbitale3 za svaku vezu, onda imamo da jesu četiri sigma s-sp veze3 (σs-sp3).
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm
