Treći zakon termodinamike bavi se ponašanjem materije s entropijom koja se približava nuli.
Prema ovom zakonu, kad god je sustav u termodinamičkoj ravnoteži, njegova se entropija približi nuli.
Drugi zakon termodinamike odnosi se na entropiju. Potom se treći zakon pojavljuje kao pokušaj uspostavljanja apsolutne referentne točke koja određuje entropiju.
Walther Nernst (1864.-1941.) Bio je fizičar koji se bavio načelima koja su bila temelj trećeg zakona termodinamike.
Prema Nernstu, entropija bi imala tendenciju imati minimalnu vrijednost ako bi temperatura čiste tvari bila jednaka ili se približavala apsolutnoj nuli.
Za to je Nernst predložio donju formulu koja pokazuje da varijacije entropije (ΔS) i temperature (T) teže minimalnim vrijednostima, odnosno 0:
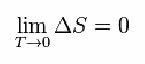
Ali što je Entropija?
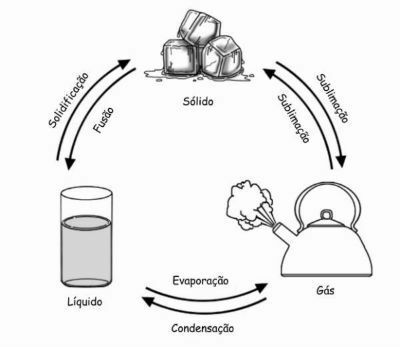
Entropija to je način na koji se molekule organiziraju u sustavu. Ova organizacija prelazi u poremećaj, ne u smislu zbunjenosti, već u smislu kretanja i uznemirenosti molekula.
Što se više molekula može kretati, što su više neorganizirani, to imaju više entropije.
U početku je Nernst sugerirao da bi entropija koju je predložio bila moguća samo na savršenim kristalima.
Na kraju je zaključio da temperatura jednaka apsolutnoj nuli ne postoji, što treći zakon čini kontroverznim zakonom.
Dakle, za mnoge fizičare ovo nije zakon već pravilo.
Nakon toliko godina (od 1912.), znanstvenici pokušavaju dobiti ovu temperaturu ili temperature koje se sve više približavaju apsolutnoj nuli. Stoga su otkrili da je to moguće samo u plinovima, odbacivši bilo koju tvar u krutom ili tekućem stanju.
Pročitajte i vi:
- Nulti zakon termodinamike
- Prvi zakon termodinamike
- Drugi zakon termodinamike
- Vježbe iz termodinamike