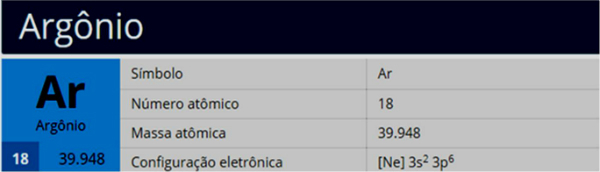
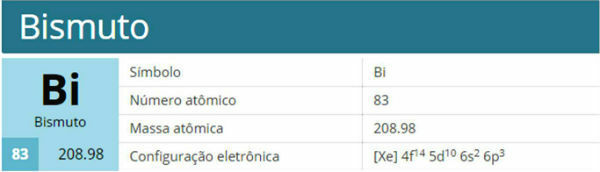
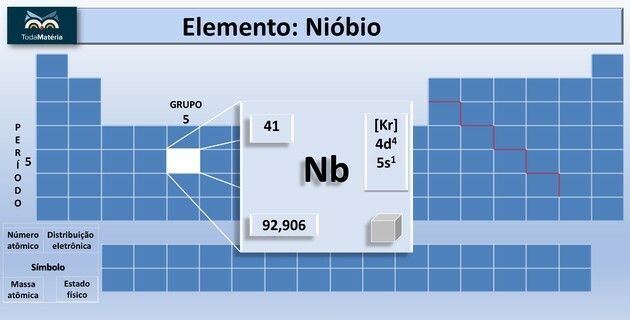
Paulingov dijagram, poznat i kao energetski dijagram, je predstavljanje elektroničke distribucije kroz podrazine snage.
Kroz shemu, kemičar Linus Carl Pauling (1901.-1994.) Predložio je nešto izvan onoga što je već bilo poznato u vezi s raspodjelom elektrona iz atoma kemijskih elemenata.
Kako bi popravio raspoloženje, Pauling je predložio energetske podrazine. Kroz njih bi bilo moguće rasporediti elektrone od najniže do najviše energetske razine atoma u osnovnom stanju.
Elektronička distribucija Linus Pauling
Prema modelu koji je predložio Pauling, elektrosfera je podijeljena na 7 elektronički slojevi (K, L, M, N, O, P i Q) oko atomske jezgre, od kojih svaka dopušta maksimalan broj elektrona, odnosno 2, 8, 18, 32, 32,18 i 8.
Na distribucija elektronike podrazine energije, pokazujući prvo elektron s najnižom energijom do postizanja elektrona s najvišom energijom.
| Elektronički slojevi | Maksimalan broj elektrona | Podrazine energije | ||||
|---|---|---|---|---|---|---|
| 1 | K | 2 i- | 1s2 | |||
| 2 | L | 8 i- | 2s2 | 2p6 | ||
| 3 | M | 18 i- | 3s2 | 3p6 | 3d10 | |
| 4 | N | 32 i- | 4s2 | 4p6 | 4d10 | 4f14 |
| 5 | O | 32 i- | 5s2 | 5p6 | 5d10 | 5f14 |
| 6 | Str | 18 i- | 6s2 | 6p6 | 6d10 | |
| 7 | P | 8 i- | 7s2 | 7p6 |
Sloj K ima samo jedan podrazina, sloj L ima dva podrazina (s i p), sloj m ima tri podrazina (s, p i d) i tako redom.
S podrazini dopuštaju do 2 elektrona, dok p podrazini dopuštaju do 6 elektrona. Dalje, podrazini dopuštaju do 10 elektrona, dok f podrazini dopuštaju do 14 elektrona.
Imajte na umu da zbroj elektrona ponašanih u svakom podrazinu po elektronskoj ljusci rezultira maksimalnim brojem elektrona u svakoj od 7 ljuski.
K: s2 = 2
L i Q: s2 + str6 = 8
M i P: s2 + str6 + d10 = 18
N i O: y2 + str6 + d10 + f14= 32
Tada je Pauling otkrio sve veći red energije:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Odatle se na dijagramu pojavljuju dijagonalne strelice za elektroničku raspodjelu elemenata:
 Paulingov dijagram
Paulingov dijagram
Primjer elektroničke raspodjele fosfora 15P:
1s2 2s2 2p6 3s2 3p3
poput do 3s2 već smo imali ukupno 12 elektrona (2 + 2 + 6 + 2), trebaju nam samo još 3 elektrona iz 3p podrazine6.
Dakle, možemo dobiti potrebnu količinu elektrona, sve dok nije veća od 6, što je maksimalni broj koji je 3p podrazina6 ponaša se.
Pročitajte i vi Sloj Valencije i Kvantni brojevi.
Riješene vježbe iz elektroničke distribucije
Pitanje 1
(Unirio) „Zubni su implantati sigurniji u Brazilu i već zadovoljavaju međunarodne standarde kvalitete. Veliki skok u kvaliteti dogodio se u procesu izrade titanovih vijaka i pribadača koji čine proteze. Izrađene od titanovih legura, ove se proteze koriste za učvršćivanje zubnih krunica, ortodontskih aparata i proteza u kostima čeljusti i čeljusti. " (Jornal do Brasil, listopad 1996.)
S obzirom da je atomski broj titana 22, njegova elektronička konfiguracija bit će:
a) 1s2 2s2 2p6 3s2 3p3
b) 1s2 2s2 2p6 3s2 3p5
c) 1s2 2s2 2p6 3s2 3p6 4s2
d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2
e) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
Ispravna alternativa: d) 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
Linus Paulingov dijagram za raspodjelu elektrona u titanu je:
pitanje 2
(ACAFE) Uzimajući u obzir bilo koji generički M element koji ima 1s elektroničku konfiguraciju2 2s2 2p6 3s2 3p6 4s2 3d5, može se reći da:
Ja njegov atomski broj je 25;
II. ima 7 elektrona u posljednjoj ljusci;
III. ima 5 nesparenih elektrona;
IV. pripadaju obitelji 7A.
Izjave su točne:
a) Samo I, II i III
b) samo I i III
c) samo II i IV
d) samo I i IV
e) samo II, III i IV
Točna alternativa: b) samo I i III.
Ja TOČNO Brojeći broj elektrona u elektroničkoj distribuciji vidimo da je korišteno 25. Stoga je atomski broj 25 i odgovara kemijskom elementu manganu.
II. POGREŠNO. Posljednji sloj, odnosno najudaljeniji sloj ima 2 elektrona, tj. 4s2.
III. TOČNO Nespareni elektroni nalaze se u podrazinu d koji sadrži do 10 elektrona, ali u elektroničkoj distribuciji mangana samo je 5 elektrona dodijeljeno podrazinu.
IV. POGREŠNO. Mangan se nalazi u obitelji 7B i u 4. razdoblju.
pitanje 3
(UFSC) Broj elektrona u svakom podrazinu atoma stroncija (38Sr) u rastućem redoslijedu energije je:
a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2
b) 1s2 2s2 2p6 3s2 3p6 4s2 4p6 3d10 5s2
c) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 5s2
d) 1s2 2s2 2p6 3s2 3p6 4p6 4s2 3d10 5s2
e) 1s2 2s2 2p6 3p6 3s2 4s2 4p6 3d10 5s2
Ispravna alternativa: a) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2.
Linus Paulingov dijagram za raspodjelu elektrona stroncija je:
Testirajte svoje znanje još više! Također riješite:
- Vježbe o elektroničkoj distribuciji
- Vježbe na periodnom sustavu