Elektroliza je a nespontana kemijska reakcija koja uključuje reakciju redukcije oksidacije koja je uzrokovana električnom strujom.
Da bi došlo do elektrolize, uključena električna struja mora biti kontinuirana i imati dovoljan napon.
Da bi uključeni ioni imali slobodu u kretanju koje obavljaju, elektroliza može nastati fuzijom (magmatska elektroliza) ili otapanjem (elektroliza u otopini).
Primjene elektrolize
Mnogi se materijali i kemijski spojevi proizvode iz postupka elektrolize, na primjer:
- aluminij i bakar
- vodik i klor u cilindru
- bižuterija (postupak galvanizacije)
- ekspres lonac
- magnezijev kotač (poklopci automobila).
Zakoni elektrolize
Zakone elektrolize razvio je engleski fizičar i kemičar Michael de Faraday (1791-1867). Oba zakona uređuju kvantitativne aspekte elektrolize.
THE prvi zakon elektrolize ima sljedeću izjavu:
“Masa elementa, nataloženog tijekom procesa elektrolize, izravno je proporcionalna količini električne energije koja prolazi kroz elektrolitsku ćeliju”.
Q = i. t
Gdje,
P: električni naboj (C)
ja: intenzitet električne struje (A)
t: vremenski interval prolaska električne (ih) struje
THE drugi zakon elektrolize ima sljedeću izjavu:
“Mase različitih elemenata, kada se tijekom elektrolize talože jednakom količinom električne energije, izravno su proporcionalne njihovim kemijskim ekvivalentima”.
M = K. I
Gdje,
M: masa supstance
K: konstanta proporcionalnosti
I: gramov ekvivalent tvari
Saznajte više u članku: Faradayeva konstanta.
Klasifikacija
Proces elektrolize može se dogoditi topljenjem ili otapanjem:
Magmatska elektroliza
Magmatska elektroliza je ona koja se prerađuje od rastopljenog elektrolita, odnosno postupkom Fuzija.
Kao primjer upotrijebimo NaCl (natrijev klorid). Kada tvar zagrijemo na 808 ° C, ona se stapa i prisutni ioni (Na+ i Cl-) počinju imati veću slobodu kretanja, u tekućem stanju.
kada električna struja prelazi u elektrolitsku ćeliju, katione Na+ privlači ih negativni pol, nazvan katoda. Već su anioni Cl-, privlači ih pozitivni pol ili anoda.
U slučaju Na+ dolazi do reakcije redukcije, dok u Cl-, postoji reakcija oksidacija.
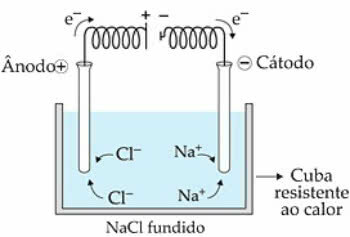
Shema magmatske elektrolize NaCl
Vodena elektroliza
U vodenoj elektrolizi, ionizirajuće otapalo je voda. U vodenoj otopini elektroliza se može izvesti obrnutim elektrodama ili aktivnim (ili reaktivnim) elektrodama.
Inertne elektrode: voda u otopini ionizira prema jednadžbi:
H2O ↔ H+ + OH-
Uz disocijacija NaCl imamo:
NaCl → Na+ + Kl-
Dakle, H kationi+ i dalje+ mogu se isprazniti na negativnom polu, dok OH anioni- i Cl- može se isprazniti na pozitivnom polu.
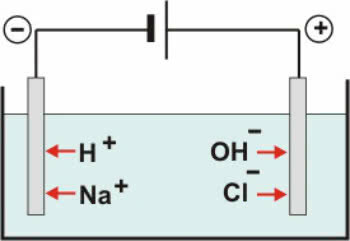
Shema vodene elektrolize NaCl
U kationima postoji reakcija redukcije (katodna redukcija), dok u anionima reakcija oksidacije (anodna oksidacija).
Dakle, imamo reakciju elektrolize:
2 NaCl + 2H2O → 2 u+ + 2 OH- + H2 + Kl2
Iz ovoga možemo zaključiti da molekule NaOH ostaju u otopini, dok H2 se oslobađa na negativnom polu i Cl2, na pozitivnom polu.
Ovaj postupak rezultirat će ekvivalentnom jednadžbom:
2 NaCl + 2H2O → 2 NaOH + H2 + Kl2
Aktivne elektrode: u ovom slučaju aktivne elektrode sudjeluju u elektrolizi, međutim trpe koroziju.
Kao primjer imamo elektrolizu u vodenoj otopini bakrenog sulfata (CuSO4):
CUSO4 → Cu2 + OS 2-4
H2O → H+ + OH-
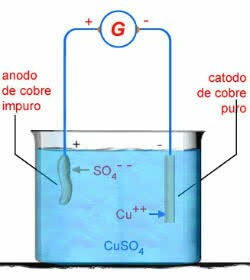 Shema vodene elektrolize CuSO4
Shema vodene elektrolize CuSO4
U tom će slučaju bakarna anoda nagrizati:
Dupe0 → Cu2+ + 2e-
To je zato što, prema standardnim potencijalima elektroda, električna struja lakše uklanja elektrone iz Cu0 nego OS 2-4 ili od oh-.
Stoga se na negativnom polu događa sljedeća reakcija elektrolize:
2e- + Cu2+ → Cu
Na pozitivnom polu imamo reakciju elektrolize:
Cu → Cu2+ + 2e-
Konačno, kada dodamo dvije jednadžbe elektrolize, kao rezultat imamo nulu.
Želite znati više o temi? Pročitajte članke:
- Ion, Kation i Anion
- Kemijske reakcije
- reakcije oksidacije-redukcije
Baterija i elektroliza
Elektroliza se temelji na inverznom fenomenu u odnosu na akumulator. U elektrolizi postupak nije spontan, kao što se događa u baterijama. Drugim riječima, elektroliza pretvara električnu energiju u kemijsku, dok stanica generira električnu energiju iz kemijske energije.
znati više o Elektrokemija.
Vježbe
1. (Ulbra-RS) Metalni kalij može se dobiti magnetskom elektrolizom kalijevog klorida. U toj izjavi označite ispravnu alternativu.
a) Elektroliza je postupak koji uključuje reakcije redukcije i redukcije oksidacije motivirane električnom strujom.
b) Magmatska elektroliza kalijevog klorida odvija se na sobnoj temperaturi.
c) Kalij se u prirodi nalazi u reduciranom obliku (K0).
d) Reakcija elektrolize odvija se uz pomoć ultraljubičastog zračenja.
e) U procesu elektrolize kalijevog klorida, da bi se dobio metalni kalij, dolazi do prijenosa elektrona iz kalija u klor.
Zamjena za
2. (UFRGS-RS) U katodi stanice za elektrolizu uvijek se nalazi:
a) Taloženje metala.
b) Polureakcija smanjenja.
c) Proizvodnja električne struje.
d) Otpuštanje vodikovog plina.
e) Kemijska korozija.
Alternativa b
3. (Unifor-CE) Sljedeći se prijedlozi odnose na elektrolizu:
Ja Reakcije elektrolize javljaju se kod potrošnje električne energije.
II. Vodene otopine glukoze ne mogu se elektrolizirati jer ne provode električnu struju.
III. U elektrolizi slanih otopina metalni kationi podvrgavaju se oksidaciji.
To možemo reći samo:
a) u pravu sam.
b) II je točan.
c) III je točan.
d) I i II su točni.
e) II i III su točni.
Alternativa
4. (FEI-SP) Dva studenta kemije izvela su BaCl elektrolizu2; prvi vodeni, a drugi vatreni. Što se tiče rezultata, možemo reći da su oba postignuta:
a) H2 to je2 na anodama.
b) H2 a Ba na anodama.
c) Cl2 a Ba na elektrodama.
d) H2 na katodama.
e) Kl2 na anodama.
Alternativni i
5. (Vunesp) "Bazen bez kemije”Oglas je koji uključuje pročišćavanje vode. Poznato je, međutim, da se tretman sastoji od dodavanja natrijevog klorida u vodu i dodavanja ovog vode kroz posudu opremljenu bakrenim i platinastim elektrodama povezanim s olovom automobil.
a) Na temelju tih podataka razgovarajte o tome je li oglasna poruka točna
b) Uzimajući u obzir inertne elektrode, napiši jednadžbe uključenih reakcija koje opravdavaju prethodni odgovor.
a) Poruka oglasa nije točna jer će doći do stvaranja kemijskih proizvoda.
b) 2 NaCl + 2H2O → 2 NaOH + H2 + Kl2 (reakcija koja stvara klor, korisna u obradi vode u bazenu)
2 NaOH + Cl2 → NaCl + NaClO + H2O (reakcija koja stvara NaClO, jako baktericidno sredstvo)


