valentni sloj to je najudaljeniji sloj (ili razina) (najudaljeniji od jezgre) atoma, odnosno onaj najudaljeniji od jezgre. Stoga ima takozvane najudaljenije elektrone ili valentne elektrone.
Broj razina koje atom može imati varira od 1 do 7, koje imaju sljedeće podrazine (u žutoj boji):
razina K (1. sloj): podnivo s
razina L (2. sloj): podrazine s i Str
razina M (3. sloj): podrazine s, Str i d
razina N (4. sloj): podrazine s, Str, d i f
razina O (5. razina): podrazine s, Str, d i f
P nivo (6. nivo): podrazine s, Str i d
razina Q (1. sloj): podrazine s i Str
Svaki od podrazina sadrži različit broj elektrona. Izgled:
podrazina s sadrži najviše 2 elektrona;
podnivo p drži najviše 6 elektrona;
podrazina d sadrži najviše 10 elektrona;
podnivo f drži najviše 14 elektrona.
Dakle, ako je valentna ljuska određenog atoma M, maksimalan broj elektrona koji to može u njemu mora biti 18 (2 elektrona iz s podrazine + 6 elektrona iz p podrazine + 10 elektrona iz podrazina d).
Postoje dva načina da se utvrdi valentna ljuska atoma i koliko elektrona ima:
→ Određivanje valentne ljuske i njen broj elektrona iz elektroničke distribucije
Elektronička distribucija uvijek se vrši putem Dijagram Linusa Paulinga, predstavljeni u nastavku:

Prikaz dijagrama Linusa Paulinga
Uobičajena atomski broj (što označava broj elektrona u atomu), vršimo elektroničku distribuciju. Na primjer, atom atomskog broja 50:

Elektronička raspodjela atoma atomskog broja jednaka 50
Analizirajući gornju raspodjelu, imamo da je razina najudaljenija od jezgre 5. (N razina), u kojoj imamo prisutnost 4 elektrona (dva u s podrazinu i 2 u p podrazinu).
→ Određivanje valentne ljuske i njenog broja elektrona iz Periodnog sustava
Tablica je poredana u razdoblja (vodoravni stupci), koji označavaju broj razina atoma, te skupine ili obitelji (okomiti stupci). Razdoblje se koristi za određivanje valentni sloj, a obitelji se koriste za određivanje broja elektrona.
a) Poznavanje razdoblja kemijskog elementa
Periodni sustav predstavlja ukupno sedam razdoblja, koji je povezan s brojem razina prisutnih u Linus Paulingovom dijagramu. Dakle, ako znamo razdoblje u kojem je kemijski element nalazi se u tablici, automatski, znamo koliko nivoa imaju vaši atomi, pri čemu je valentni sloj najudaljeniji od jezgre.
1. primjer: Kemijski element Kalij
Kalij se nalazi u četvrtom razdoblju Periodnog sustava, tako da njegov atom ima četiri razine, četvrta razina je valentni sloj, što se potvrđuje njegovom raspodjelom elektronika.
Elektronička raspodjela elementa kalija
2. primjer: Kemijski element Fluor
Fluor se nalazi u drugom razdoblju Periodnog sustava, pa njegov atom ima dva razine, a druga razina je valentni sloj, što se potvrđuje njegovom raspodjelom elektronika.

Elektronička distribucija elementa fluora
3. primjer: kemijski element indij
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Indijanac se nalazi u petom razdoblju Periodnog sustava, tako da njegov atom ima pet razine, peta razina je valentni sloj, što se potvrđuje njegovom raspodjelom elektronika.

Elektronička distribucija elementa indija
b) Poznavanje obitelji ili skupine kemijskog elementa
Poznavajući obitelj ili skupinu u kojoj se nalazi element, također znamo broj elektrona prisutnih u valentnoj ljusci tog elementa.
Elementi obitelji A
Elementi obitelji A smješteni su u stupce 1, 2, 13 do 18 Periodnog sustava. Svaki od ovih stupaca prima broj (1 do 8, rimski broj), koji točno označava broj elektrona u valentnoj ljusci ovih elemenata:
Stupac 1 - obitelj IA = svi imaju 1 elektron u valentnoj ljusci;
Stupac 2 - obitelj IIA = svi imaju 2 elektrona u valentnoj ljusci;
Stupac 3 - obitelj IIIA = svi imaju 3 elektrona u valentnoj ljusci;
Stupac 4 - IVA obitelj = svi imaju 4 elektrona u valentnoj ljusci;
Stupac 5 - obitelj VA = svi imaju 5 elektrona u valentnoj ljusci;
Stupac 6 - VIA obitelj = svi imaju 6 elektrona u valentnoj ljusci;
Stupac 7 - obitelj VIIA = svi imaju 7 elektrona u valentnoj ljusci;
Stupac 8 - obitelj VIIIA = svi imaju 8 elektrona u valentnoj ljusci.
Pogledajte neke primjere određivanja broja valentnih elektrona nekih elemenata porodice A:
Primjer 1: kemijski element barij
Barij se nalazi u obitelji IIA, pa u valentnoj ljusci ima dva elektrona, što potvrđuje i njegova elektronička raspodjela:

Elektronička distribucija elementa Barium
Primjer 2: Kemijski element antimona
Antimon se nalazi u obitelji VA, pa u valentnoj ljusci ima pet elektrona, što potvrđuje i njegova elektronička raspodjela:

Elektronička distribucija elementa antimona
Primjer 3: Ksenonski kemijski element
Ksenon se nalazi u obitelji VIIIA, pa u valentnoj ljusci ima osam elektrona, što potvrđuje i njegova elektronička raspodjela.

Elektronička distribucija ksenonskog elementa
NAPOMENA: jedini hemijski element koji pripada obitelji A koji nije u skladu s predloženim pravilom je helij. Pripada obitelji VIIIA, ali ima samo dva elektrona u valentnoj ljusci. To je zato što je njegov atomski broj 2, pa mu je nemoguće imati 8 elektrona u valentnoj ljusci kao i ostali elementi u obitelji.
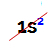
Elektronička distribucija atoma helija
Elementi obitelji B
Elementi obitelji B smješteni su u stupcima 3 do 12 Periodnog sustava. Pored obitelji A, postoji i osam obitelji B, koje su predstavljene rimskim brojevima. Za razliku od obitelji A, broj obitelji B ne određuje broj elektrona u valentnoj ljusci.
Broj elektrona u valentnoj ljusci elementa porodice B uvijek je jednak 2, bez obzira na atomski broj i položaj u tablici. Elektronička distribucija kalifornija (98Cf) i hassius (108hs) dokažite ovo:
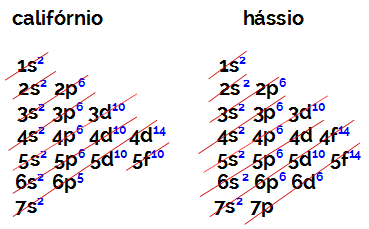
Elektronička distribucija kalifornija ima kao najenergičniji podrazina 5f10, a o hassius je 6d6. U oba slučaja, podnivo najudaljeniji od jezgre je sedma razina i oba imaju dva raspoređena elektrona.
Ja, Diogo Lopes Dias
