Kao što je objašnjeno u tekstu "Vrste intermolekularnih sila", molekule tvari u tri fizička stanja (krutom, tekućem i plinskom) privlače jedna od intermolekularnih sila.
Tri poznate intermolekularne sile su: inducirani dipol - inducirani dipol, trajni dipol - trajni dipol i vodikova veza. Među njima je vodikova veza najjača. Neki su autori ovu intermolekularnu silu nazivali vodikovim vezama; međutim, točan izraz koji prihvaća IUPAC je "vodikova veza".
Ova vrsta interakcije događa se kada je molekula vezana vodikom na fluor, dušik ili kisik, koji su snažno elektronegativni atomi.

Vodikova veza je ekstremni primjer trajne dipol-trajne dipolne veze. Jer vodik molekule čini pozitivan pol, koji se veže za jedan od onih atoma fluora, kisika ili dušika druge molekule, koji čine njihov negativni pol.
Uobičajeno se javljaju intermolekularne veze s tvarima u tekućem i krutom stanju. Također, budući da je riječ o vrlo intenzivnoj sili privlačenja, potrebna je vrlo velika energija da bi se ona slomila.
Tvar koja ima tu intermolekularnu silu je sama voda. Primijetite kako se to događa na donjoj ilustraciji:
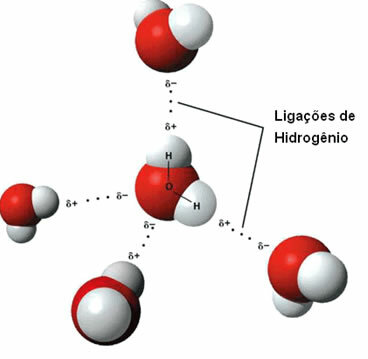
Imajte na umu da je svaka molekula vode prostorno okružena s još četiri molekule vode, s vezama vodika nastaju vezom između vodika jedne molekule (pozitivni pol) s kisikom druge (pola negativan).
Vodikove veze objašnjavaju različite pojave u prirodi, vidi sljedeće primjere:
- Činjenica da led pluta po vodi: Led je manje gust od vode i posljedično pluta po njemu. To je zato što su dok su u tekućem stanju vodikove veze koje se javljaju između molekula vode poredane u neorganiziranom obliku, vodikove veze u Molekule leda su više razmaknute i organizirane, tvoreći krutu heksagonalnu strukturu, zbog čega molekule zauzimaju puno veći prostor nego što bi bile da su u državi. tekućina.

Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
To je čak i razlog zašto stavimo li vodu u puni volumen boce i stavimo je kasnije u hladnjak, njezin će se volumen proširiti i boca će puknuti.
Dakle, bit će ista količina molekula po jedinici volumena, što smanjuje gustoću, prema formuli gustoće: d = m / v. Između formiranih šesterokuta bit će praznih prostora, što smanjuje gustoću ove tvari.
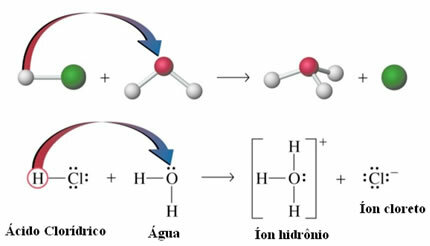
- Kisela ionizacija: Iako su vodikove veze otprilike deset puta slabije od kovalentnih veza; pod određenim okolnostima uspiju raskinuti kovalentne veze. Na primjer, u slučaju prikazanom dolje, solna kiselina se otopi u vodi. Kisik u vodi privlači vodik vezan za klor kiseline više od samog klora, što dovodi do pojave hidronijevih iona (H3O+) i klorid (Cl-). Taj se fenomen naziva ionizacijom:
- Površinski napon vode: molekule na površini tekućine privlače se vodikovim vezama samo s molekulama na boku i dolje, jer gore nema molekula. Molekule koje su ispod površine, s druge strane, provode ovu vrstu vezivanja s molekulama smjerima, rezultat je stvaranje neke vrste filma ili tankog sloja na površini vode koji uključuje.
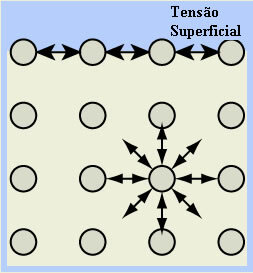
To objašnjava činjenicu da na njoj mogu ostati insekti, kao i fenomen sfernog oblika kapljica vode.

Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Vodikove veze"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/ligacoes-hidrogenio.htm. Pristupljeno 27. lipnja 2021.
Kemija

Onečišćenje vode, fizički aspekti vode, kemijski aspekti vode, biološki aspekti vode, industrijski otpad, teški metali, voda za piće, organske tvari, zamućenost vode, kanalizacija.
