Alotropija je pojava koja se javlja kada isti kemijski element ima svojstvo stvaranja više od jedne jednostavne tvari.. Ove alotropne sorte mogu se razlikovati zbog broja atoma elementa koji su povezani u molekuli ili zbog rasporeda atoma u kristalnoj rešetki.
Jedan od elemenata koji imaju alotropne sorte je fosfor (P), a najčešći je bijeli fosfor to je crveni fosfor. Ove dvije fosforne alotrope ne razlikuju se po različitom prostornom rasporedu, jer se obje u osnovi sastoje od tetraedarskih molekula, već količina atoma fosfora kod svakog je različita.
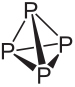
Pogledajte sastav i glavne karakteristike bijelog i crvenog fosfora:
- Bijeli fosfor:
Molekularna formula bijelog fosfora je Str4, što znači da se njegove molekule sastoje od četiri atoma fosfora.

Ova vrsta fosfora izuzetno je reaktivna, uglavnom zbog napetosti pod uglovima od 60 ° između njezinih veza. Toliko je reaktivan da ga treba čuvati u vodi kako ne bi došao u kontakt sa zrakom i eksplodirao. Prilikom rukovanja njime morate biti vrlo oprezni jer uzrokuje ozbiljne opekline kože i trovanje ako se proguta (samo 0,1 g unesenog bijelog fosfora može dovesti do smrti).
Kao što možete vidjeti dolje, bijeli fosfor je krutina poput bijelog voska.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)

Bijeli fosfor pohranjen u vodi kako ne bi došao u kontakt sa zrakom *
Ako se zagrije u nedostatku zraka, bijeli fosfor pretvara se u crveni fosfor.
- crveni fosfor:
Crveni fosfor nema utvrđenu strukturu, ali postoje dokazi da je riječ o makromolekulama nastalim vezanjem spomenutih tetraedarskih struktura (P4), kojeg zastupa StrNe.
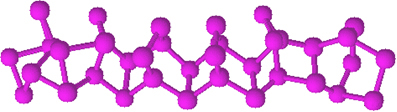
Puno je manje reaktivan od bijelog fosfora, no ako se protrlja, može se zapaliti. Zbog toga se koristi na bočnim površinama kutija šibica. Kad trljamo čačkalicu po površini kutije, šibica se zapali i zapaljuje lako zapaljiv materijal na glavi čačkalice.
U nekim zemljama šibica se stavlja na glavu čačkalice u obliku P.4s3.
Crveni fosfor je amorfni prah, odnosno nema kristalnu strukturu i tamnocrvene je boje, kao što je prikazano dolje:

Crveni fosfor u prahu.
* Autorstvo slike pripada W. Oelen i nju se može naći ovdje.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Alotropija fosfora"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm. Pristupljeno 28. lipnja 2021.
Kemija
Što je alotropija, jednostavne tvari, plinoviti kisik, ozon, alotropni oblici, kemijski element kisik, ultraljubičaste zrake sunca, dijamant, grafit, atomskost, bijeli fosfor.


