Kad izgovorimo riječ "ravnoteža", padne nam na pamet objekt koji ostaje unedogled. Međutim, ovo je samo jedna vrsta ravnoteže, tzv “Statička ravnoteža”.
Tu je i “Dinamička ravnoteža”. U njemu, kao što i samo ime kaže, ne postoji niti jedan trenutak u kojem se predmet ili pojava još uvijek nalazi. Na primjer, da biste razumjeli, pogledajte donju ilustraciju i imajte na umu da je količina vode koja padne u posudu jednaka količini koja istječe iz nje, održavajući razinu vode konstantnom. U tom slučaju kažemo da postoji dinamička ravnoteža, ravnoteža u pokretu.

Takva se ravnoteža događa u reverzibilne reakcije, odnosno u onim reakcijama koje se javljaju u oba smjera. Istodobno kad se molekule reaktanata pretvaraju u produkte, molekule produkata međusobno reagiraju da bi stvorile reaktante. Reverzibilnost reakcije predstavljena je strelicama u oba smjera:
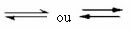
Kada je brzina razvoja izravne reakcije (nastajanja proizvoda) jednaka brzini razvoja inverzna reakcija (stvaranje reaktanata), pod konstantnom temperaturom, znači da je reakcija postigla ravnotežu kemijska.
A u slučaju reakcija s prisutnošću samo molekula u reaktantima i produktima, imamo molekularna ravnoteža.Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Slijedi primjer reakcije koja se događa između plinovitog vodika (H2) i plinoviti jod (I2), za stvaranje plina vodikov jodid (HI):
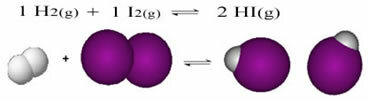
Na početku reakcije brzina razvoja izravne reakcije bila je veća, nakon što je koncentracija reaktanata bila maksimalna, a produkata nula. Tako je i stopa razvoja obrnute reakcije bila nula.
Međutim, s vremenom plinovi vodik i jod reagiraju, stvarajući proizvod. Na taj se način koncentracija reagensa počinje smanjivati, a njihov stupanj razvoja također opada.
Kako se koncentracija proizvoda povećava, a koncentracija reaktanata smanjuje, brzina razvoja inverzne reakcije počinje rasti. Ako se temperatura održava konstantnom, doći će vrijeme kada će dvije brzine razvoja ostati iste, pokazujući tako da je reakcija dosegla kemijsku molekularnu ravnotežu.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Molekularna ravnoteža"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm. Pristupljeno 28. lipnja 2021.



