Svaka je stanica uređaj u kojem se javlja spontana reakcija redukcije oksidacije koja generira električnu struju koja se, pak, koristi za rad neke opreme.
Ti su uređaji dobili ime jer je prvu stvorenu bateriju izumio Alessandro Davne 1800. godine nastali su od cinkovih i bakrenih diskova odvojenih pamukom natopljenim salamura. Ovaj je set postavljen prošaran, jedan na drugi, gomilaju diskove i čineći veliki stupac. Kako je bilo baterija diskova, počeo se nazivati tim imenom.

Baterije se uvijek sastoje od dvije elektrode i elektrolita. Pozitivna elektroda naziva se a katoda i tu je reakcija smanjenje. Negativna elektroda je anoda i tu je reakcija oksidacija. Elektrolit se također naziva solni most a otopina je za provođenje iona.
Da biste razumjeli kako ovo stvara električnu struju, pogledajte slučaj jedne od prvih baterija, Danielova hrpa, u kojem se nalazio spremnik s otopinom bakrenog sulfata (CuSO4 (vod.)) i, umočena u tu otopinu, bila je bakrena ploča. U drugom zasebnom spremniku nalazila se otopina cinkovog sulfata (ZnSO
4 (vod.)) i umočenu cink ploču. Dvije otopine bile su povezane mostom od soli, koji je bio staklena cijev s otopinom kalijevog sulfata (K2SAMO4 (vod.)) sa staklenom vunom na krajevima. Napokon, dvije su ploče međusobno povezane vanjskim krugom, sa svjetiljkom, čija bi rasvjeta ukazivala na prolazak električne struje: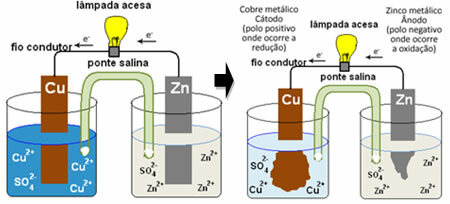
Ono što se događa je da cink ima veću tendenciju oksidacije, odnosno gubitka elektrona, pa metalni cink u oštrici djeluje kao negativna elektroda, anoda, gdje dolazi do oksidacije: Zn(s) ↔ Zn2+(ovdje) + 2 i-. Elektroni koje cink gubi prenose se vanjskim krugom do bakra, stvarajući električnu struju koja uključuje žarulju. Ioni bakra u otopini primaju elektrone (reduciraju se) i transformiraju se u metalni bakar koji se taloži na bakrenom limu. To znači da je ovo pozitivna elektroda, katoda, gdje dolazi do smanjenja: Dupe2+(ovdje) + 2 i- ↔ magarac(s).
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Današnje baterije imaju isti princip rada, u kojem jedan metal dovodi elektrone drugom, kroz vodljivu otopinu, i stvara se električna struja. Razlika je u tome što su baterije koje se danas koriste suhe, jer ne koriste tekuću otopinu kao elektrolit, kao što se događa u Daniellinoj bateriji.
Danas postoji vrlo široka paleta baterija koje se prodaju komercijalno. Među njima su najčešći kiselinske stanice (iz Leclanchéa) ialkalne baterije.
Obje imaju cink kao negativnu elektrodu; s druge strane, kao pozitivan pol, na sredini hrpe ugrađena je grafitna šipka okružena manganovim dioksidom (MnO2), ugljen u prahu (C) i mokra pasta. Razlika je u tome što se u hrpi kiselina amonijev klorid (NH) koristi u mokroj pasti.4Cl) i cinkov klorid (ZnCl2) - kisele soli - pored vode (H2O). U alkalnoj bateriji koristi se kalijev hidroksid (KOH), koji je baza.

Leclanché baterije su najprikladnije za opremu koja zahtijeva lagano i kontinuirano pražnjenje, poput daljinskog upravljača, zidnog sata, prijenosnog radija i igračaka. Alkalne baterije, s druge strane, imaju 50 do 100% više energije od uobičajene baterije iste veličine, što se preporučuje za opremu koja zahtijevaju brže i intenzivnije preuzimanja kao što su radio, CD / DVD uređaji, prijenosni MP3 uređaji, svjetiljke, digitalni fotoaparati itd.

Saznajte više o tome koji se elektroliti i elektrode koriste i u ovim i u drugim vrstama baterija. što se tiče vrsta opreme koja im se najviše preporučuje, pročitajte više povezane članke ispod.
Napisala Jennifer Fogaça
Diplomirao kemiju

