Baterija to je sustav u kojem se kemijska energija spontano pretvara u električnu energiju.
1836. godine engleski je kemičar i meteorolog John Frederic Daniell (1790.-1845.) Izgradio hrpu različitu od one poznate u to vrijeme: hrpu Alessandra Volte. Na ovoj hrpi on međusobno povezane dvije elektrode koje su bile sustavi koji se sastoje od metala uronjenog u vodenu otopinu soli nastale kationima ovog metala.
Jedna od elektroda, bakrena elektroda, sastojala se od bakrene ploče umočene u otopinu bakrenog sulfata (CuSO4). Druga elektroda bila je cinkova elektroda, koja se sastojala od cinkove ploče uronjene u otopinu cinkovog sulfata (ZnSO4).
Te su dvije elektrode međusobno povezane električnim krugom koji je sadržavao lampu, jer ako bi se uključila, to bi ukazivalo na pojavu električne struje.
Također, između njih je bio most od soli. Ovaj most sastojao se od staklene cijevi u obliku slova U koja je sadržavala koncentriranu vodenu otopinu visoko topive soli, poput kalijevog klorida (KCl (aq)), na primjer. Krajevi cijevi presvučeni su pamukom ili agarom.
Ispod imamo strukturu ove stanice ili elektrokemijske stanice, koja je postala poznata kao Danielova stanica. Sjećajući se da se svaka elektroda naziva polućelija.
Kad je krug zatvoren, lampica se uključuje i nakon nekog vremena, cink ploča je korodirala i masa joj se smanjila, dok je bakrena ploča suprotno, masa joj se povećava (kao što je prikazano na donjoj slici). Također se napominje da dolazi do povećanja koncentracije u mol / L iona Zn2+ te smanjenje iona Cu2+.
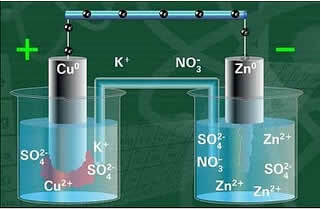
Shema Danielova slaganja.
Zašto se ovo događa?
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Da bismo razumjeli, pogledajmo reakcije koje se odvijaju na svakoj elektrodi zasebno.
U cinkovoj elektrodi dolazi do slijedeće ravnotežne reakcije:
Zn (s) ↔ Zn2+(ovdje) + 2 i-
To znači da metalni cink (iz ploče) podvrgava oksidaciji, tj. Donira dva elektrona kationu cinka (iz otopine) i postaje Zn2 +. Također se događa suprotno, cink kation prisutan u otopini prima dva elektrona donirana od cinka i postaje metalni cink. Stoga postoji neprekinuti proces oksidacije i redukcije.
Isto se odnosi i na bakrenu elektrodu koja će imati globalnu reakciju u dinamičkoj ravnoteži: Cu (s) ↔ Cu2+(ovdje) + 2 i-
Daniell je shvatio da ako poveže ove dvije elektrode, reaktivnija će donirati svoje elektrone manje reaktivnom kationu, umjesto da to radi s kationima u vlastitom rješenju. U ovom je slučaju cink najaktivniji i podvrgava se oksidaciji, donirajući elektrone bakru, što dovodi do smanjenja njegove mase. Elektroda koja prolazi oksidaciju je negativni pol, koji se naziva anoda. Bakrena elektroda je ona koja prolazi kroz redukciju, kation bakra prima dva elektrona iz cinka, a naziva se katoda (pozitivni pol).
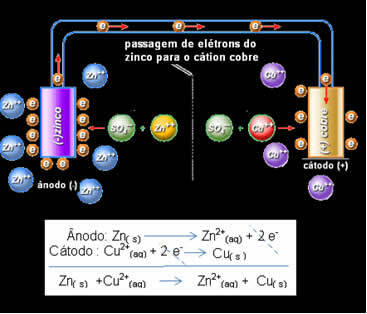
Prolaz elektrona i globalna jednadžba Danielova sloga.
Iznad imamo globalnu jednadžbu za ovaj stog koja se dobiva zbrajanjem dviju polureakcija. Njegov prikaz ili kemijski zapis izrađen je prema sljedećem pravilu:

Dakle, za Daniell-ov stog imamo:
Zn / Zn2+// Ass2+ / magarac
Napisala Jennifer Fogaça
Diplomirao kemiju
Brazilski školski tim
Fizičko-kemijska - Kemija - Brazil škola
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Danilova hrpa"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Pristupljeno 28. lipnja 2021.

