THE energija vezanja je uključen u pauziiliu treningu jedne ili više veza između atoma molekule. Na primjer, molekula plinovitog vodika ima jednostruku vezu (sigma) između uključenih atoma:

Strukturna formula vodikovog plina
Da bi ova molekula mogla nastati, stvorena je jednostruka veza između njezinih atoma. Kada ova molekula sudjeluje u kemijskoj reakciji s plinovitim klorom (Cl2), na primjer, za stvaranje klorovodične kiseline (HCl), jednostruke veze prisutne u H2 a u Cl2 mora se prekinuti s posljedičnim stvaranjem jednostruke veze u HCl.
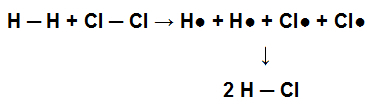
Prikaz prekida jednostruke veze u reagensu i stvaranja jednostruke veze u proizvodu
Atomi se povezuju kako bi postigli svoje elektronička stabilnost, odnosno prelaze iz više energetske situacije u nižu energetsku situaciju. Dakle, možemo reći da se pri stvaranju veze između atoma oslobađa energija; dakle, posljedično, njegova razgradnja ovisi o apsorpciji energije.
Ako to razumijemo prekid (pucanje) kemijske veze događa se kada joj se ona isporučuje količina energije (xKcal)
, zaključili smo da je ovo proces endotermički. Nasuprot tome, stvaranje veze uključivat će puštanje daje ista količina energije (-xkcal), biti, dakle, proces egzotermno.Kao kemijske reakcije klasificiraju se na endotermne ili egzotermne, možemo upotrijebiti znanje o vezivnim energijama molekula reaktanata i proizvoda kako bismo odredili promjenu energije (ΔH) kemijskog procesa, a zatim ga klasificirali.
Na primjer, pogledajte jednadžbu u nastavku:
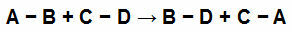
Kemijske veze u sudionicima kemijske jednadžbe
Imamo jednostavne poveznice u svakom od sudionika reakcije. Imaju sljedeće vrijednosti:
[A-B] = 50 Kcal
[CD] = 100 Kcal
[D-D] = 80 Kcal
[PRIJE KRISTA] = 230 Kcal
S gornjim vrijednostima možemo izračunati energiju koja je uključena u razbijanje veza reaktanata i stvaranje veza proizvoda na sljedeći način:
U reagensima
50 Kcal za prekid AB veze i 100 Kcal za prekid CD veze, odnosno u reagensu će se za prekidanje veza koristiti 150 Kcal.
U proizvodima
80 Kcal za stvaranje BD veze i 230 Kcal za stvaranje AC veze, odnosno u proizvodu će se osloboditi 310 Kcal u stvaranju veza
S vrijednostima energija uključenih u reaktante i produkte moguće je znati je li reakcija apsorbirala ili oslobodio više energije samo oduzimanjem energije koja se koristi u prekidu od energije oslobođene u formacija:
ΔH = Energija reagensa - Energija proizvoda
ΔH = 230 - 310
ΔH = -80 Kcal
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Kako reakcija ima više oslobađanja energije nego apsorpcije, negativni ΔH je stoga egzotermičan.
BILJEŠKA: Ako se stehiometrijski koeficijent sudionika razlikuje od 1, moramo pomnožiti energetsku vrijednost veze s koeficijentom, na primjer:
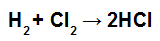
Jednadžba formiranja HCl
Budući da je koeficijent HCl 2, vrijednost vezanja HCl moramo pomnožiti s 2.
Sada slijedite razlučivanje vježbe o energiji vezanja u kemijskoj reakciji:
Primjer: S obzirom na sljedeće energije vezanja, u kilodžulima po molu veze (apsolutne vrijednosti):
H - H = 436
N ≡ N = 945,6
N - H = 391
Izračunajte toplinu (u kilodžulima po molu NH3 (g)) uključeni u reakciju koju predstavljaju:
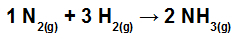
Kemijske veze u reakciji stvaranja NH3
Rješenje:
Prvi korak u rješavanju ove vježbe je prepisivanje jednadžbe koja pokazuje kemijske veze prisutne u svakoj od molekula:
Ne2: imamo trostruku vezu (jer N, obitelj Dušika, mora stvoriti tri veze jer u valentnoj ljusci ima pet elektrona);
u H2: Imamo jednostruku vezu (jer H mora stvoriti samo jednu vezu jer u valentnoj ljusci ima samo jedan elektron);
u NH3: Imamo tri jednostavne veze (jer svaka H treba vezu, a N tri veze).
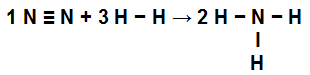
Jednadžba koja pokazuje veze u stvaranju NH3
Kako je vježba pružila vrijednosti za svako vezivanje, prvi korak je odrediti energiju vezanja povezanu sa svakim od sudionika:
- U N.2
Imamo 1 mol u N2u jednadžbi i, da bismo prekinuli vašu vezu, trebamo 945,4 KJ, dakle:
1.945,4 = 945,4 KJ
- U H2
Imamo 3 mol u H2u jednadžbi i, da bismo prekinuli vašu vezu, trebamo 436 KJ, dakle:
3.346 = 1038 KJ
- U NH3
Imamo 2 mola NH3u jednadžbi, ali postoji tri puta veća veza N-H, pa pomnožimo količinu energije koja je uključena da nastane ta veza sa 2 i 3:
2.3.391 = 2346 KJ
Konačno, možemo odrediti toplinu koja je uključena u reakciju oduzimanjem energije koja se koristi za razbijanje reaktanta od energije koja se oslobađa pri stvaranju proizvoda:
ΔH = energija u reaktantima - energija u proizvodima
ΔH = (945,4 + 1038) - 2346
ΔH = 1983,4 - 2346
ΔH = - 362,6 KJ po molu NH3 (g)
Kako je varijacija bila negativna, to znači da je energija koja se oslobađa pri stvaranju veza u proizvodima bila veća od energije apsorbirane u prekidanju veza reaktanata, dakle, reakcija je egzotermna.
Ja, Diogo Lopes Dias
