Kad razgovaramo o pH, referiramo se na hidrogenionski potencijal otopine, odnosno na količinu hidronijevih kationa (H+ ili H3O+) koji su raspršeni u otapalu otopine.
Katoni hidronija dobro su poznati zbog definicije koju je predložio znanstvenik Arhenije za kiselinu. Ovaj znanstvenik to tvrdi kiselina je li svaka tvar sposobna jonizovati i stvaraju hidronijeve ione u vodenom mediju.
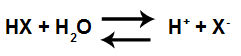
Jednadžba kiselinske jonizacije
kratica pH služi kao referenca za određivanje razine kiselosti medija. Međutim, kemičari već dugo koriste i pH kao referenca za određivanje, osim kiselosti, je li medij bazičan ili neutralan.
To je moguće jer su kemičari sada svjesni da se voda podvrgava samoionizaciji, odnosno proizvodi hidronije (H+) i hidroksidi (OH-). Dakle, vodena otopina nikad nema samo hidronij ili hidroksid, već oboje, kao što možemo vidjeti iz sljedeće jednadžbe:

Jednadžba autoionizacije vode
Vrijednosti korištene kao referenca za pH
Vrijednosti korištene za pH odnose se na ionizacijsku konstantu (Kw) vode pri temperaturi od 25
OC, što je jednako 10-14. Pri ovoj temperaturi koncentracije hidronija i hidroksidnih iona koje proizvodi voda apsolutno su jednake, odnosno 10-7 mol / L.[H+] = [OH-]= 10-7
Od ove reference, vrijednosti korištene za pH kreću se od 0 do 14.
Formule za izračunavanje pH
a) Izračun iz koncentracije u mol / L hidronijevih kationa
Izračun pH vrijednosti može se izvršiti izravno, sve dok znamo koncentraciju hidronija ([H+]). Izgled:
pH = -log [H+]
ili
10-pH = [H+]
b) Izračun iz koncentracije hidroksidnih aniona (OH-)
pOH = -log [OH-]
ili
10-pOH = [OH-]
Nakon izračuna vrijednosti pOH, trebate je upotrijebiti u sljedećem izrazu za određivanje pH vrijednosti.
pH + pOH = 14
Tumačenje pH vrijednosti
Poznavajući pH vrijednost, možemo utvrditi ima li dotična otopina kiseli, bazični ili neutralni karakter. Da biste to učinili, samo upotrijebite sljedeći shematski odnos:
Za pH vrijednosti ispod 7 = kiseli medij;
Za pH vrijednosti 7 = neutralni medij;
Za pH vrijednosti iznad 7 = osnovni medij.
Primjeri
1. primjer: Znajući da je koncentracija kationa hidronija u otopini 2,10-4 mol / L, kolika bi trebala biti pH vrijednost ove otopine?
Da bi se odredila pH vrijednost otopine iz koncentracije hidronija (H+), 2.10-4 mol / L, moramo upotrijebiti sljedeći izraz:
pH = -log [H+]
pH = -log [2.10-4 ]
pH = - (log 2 + log 10-4)
pH = -log2 - log10-4
pH = –log 2 - 4.log 10
pH = –0,3 + 4. (1)
pH = -0,3 + 4
pH = 3,7
2. primjer: Otopina koju tvori određena otopljena tvar ima koncentraciju hidroksidnih iona 10-11 mol / L. Iz ove koncentracije možemo reći da vrijedi pH ove otopine?
Da bi se odredila pH vrijednost otopine iz koncentracije hidroksida, 10-11 mol / L, moramo učiniti sljedeće:
1O Korak: izračunati vrijednost pOH.
10-pOH = [OH-]
10-pOH = 10-11
Izraz moramo pomnožiti s -1 jer je pOH uvijek pozitivna nepoznanica.
-pOH = -11. (- 1)
pOH = 11
2O Korak: izračunati pH vrijednost.
pH + pOH = 14
pH + 11 = 14
pH = 14 - 11
pH = 3
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ph.htm
