Baterija je uređaj u kojem se električna struja proizvodi iz kemijske energije koja dolazi iz a reakcija oksidoredukcije, odnosno jedna vrsta reaktanta gubi elektrone (oksidacija), dok druga vrsta dobiva elektrone (redukcija).
Pogledajte prikaz reakcija oksidacije i redukcije koje se javljaju u bilo kojem slogu:
Oksidacija: X → i + X+
Vrsta X gubi elektron i pretvara se u kation.
Smanjenje: Y- + i → Y
Y anion- dobiva elektron i pretvara se u neutralnu Y vrstu.
Osnovne sastavnice stoga
Osnovne komponente stoga su:
Anoda: negativna elektroda u kojoj se odvija reakcija oksidacije, odnosno gubitak elektrona;
Katoda: pozitivna elektroda u kojoj se odvija reakcija redukcije, odnosno pojačanje elektrona;
Elektrolitička otopina (solni most) ili vodljivi materijal (kao što je grafitna šipka): sredstvo je kojim elektroni odrečeni anodom dođu do katode.
Osnove rada baterije
Funkcioniranje stoga događa se iz sljedećih događaja:
1. načelo: Oksidacija anode
Metal u anodi, budući da ima veću tendenciju gubljenja elektrona, postaje kation, kao što smo primijetili u donjoj jednadžbi:
Zn → Zn2+ + 2 i
2. načelo: redukcija katode
Kationi koji su dio materijala prisutnog u katodi (za primjer ćemo upotrijebiti bakar) prilikom primanja elektroni s anode pretvaraju se u metalni bakar, kao što vidimo u jednadžbi dolje:
Dupe2+ + 2e → Cu
prve hrpe
a) Baterija Alessandra Volte
Alessandrova hrpa (prva hrpa u povijesti), sastavljena 1800. godine, oblikovana je interkaliranim metalnim diskovima, kao na donjoj slici:

Skup sličan Alessandrovom Povratak na hrpu
Diskovi su se preplitali jer su imali drugačiji sastav. Jedna je bila izrađena od metala cinka, a druga od bakra, uvijek odvojena pamukom namočenim u salamuri (otopini koju tvore voda i sol).
B) Danielova hrpa
Danielova hrpa, sastavljena 1836. godine, sastojala se od dvije polućelije povezane provodnom žicom i slanim mostom.
Polućelija 1: to je bila anoda, odnosno negativni pol baterije.
Sastojala se od cinkove ploče, a dio ploče je potopljen u otopinu koju su stvorili voda i cinkov sulfat (ZnSO4).
Pola ćelije 2: to je bila katoda, odnosno pozitivni pol baterije.
Sastojala se od bakrene ploče, a dio te ploče potopljen je u otopinu koju su stvorili voda i bakreni sulfat (CuSO4).
solni most
Cijev u obliku slova U koja je sadržavala otopinu koju su stvorili voda i kalijev klorid (KCl), koja je povezivala dvije polućelije (cink i bakar) i na oba kraja imala staklenu vunu.
baterije
Trenutno postoji nekoliko modela stogova, ali općenito izgledaju ovako:
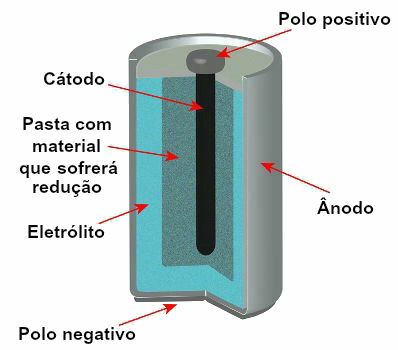
Shema koja predstavlja model trenutnog stoga
Najčešće korišteni modeli su takozvana Leclanchéova baterija i alkalna baterija, koje imaju sljedeće razlike:
The) Leclanche hrpa
Ima anodu koju tvori metalni cink;
Ima katodu koju tvori pasta s amonijevim kloridom, vodom, škrobom i mangan-dioksidom;
Ima grafitnu šipku koja služi kao vodič elektrona koji odlaze od katode prema anodi.
B) Alkalna baterija
Ima anodu koju čine metalni cink ili kadmij;
Ima katodu koju čine živin oksid, nikal-oksid i jod;
U materijalu koji čini katodu mora imati miješanu osnovu.
Ja, Diogo Lopes Dias
Izvor: Brazil škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm

