Radioaktivnost je svojstvo kakvo imaju neki atomi urana i radio, moraju izdati spontano energije u obliku čestice i val, postajući kemijski elementi stabilniji i lakši.
Vrste
Radioaktivnost se predstavlja s dva puta različita zračenja: čestica - alfa (α) i beta (β); i elektromagnetski val - gama zrake (γ).
alfa zrake: one su pozitivne čestice sastavljene od dva protona i dva neutrona i male snage prodiranja.
beta zrake: su negativne čestice koje ne sadrže masu koja se sastoji od elektrona (zanemariva masa), a njihova je penetracijska snaga veća od snage alfa zraka, ali manja od snage gama zraka.
Gama: oni su visokoenergetski elektromagnetski valovi i, budući da nisu čestice, nemaju ni masu.
Pročitajte i vi: Formule radioaktivnosti
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
zakoni
Radioaktivna emisija čestica prati određena ponašanja koja se objašnjavaju zakonima radioaktivnosti (jedna za alfa česticu i jedna za beta česticu), koje je opisao kemičar Engleski Frederick Soddyte poljski kemičar i fizičar Kazimierz Fajans.
Prvi zakon radioaktivnosti
Prema ovom zakonu, kad radioaktivni atom emitira zračenje alfa tipa, nastat će novi atom s jezgrom koja sadrži dva protona i dva neutrona manje, ukupno mase četiri jedinice manje. Prvi zakon radioaktivnosti možemo predstaviti sljedećom generičkom jednadžbom:
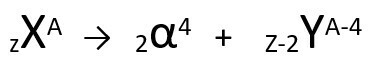
Generička jednadžba prvog zakona radioaktivnosti.
Pogledajmo primjer:
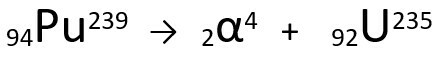
Jednadžba koja predstavlja emisiju α-čestica od Plutonija-239.
Imajte na umu da, prilikom emitiranja alfa zračenja, novonastali atom, Uranij-235, ima maseni broj četiri jedinice manji i atomski broj za dvije jedinice manji - točno vrijednosti koje odgovaraju α čestici koju emitira jezgra plutonij. Da biste saznali više o tome, idite na: Prvi zakon o radioaktivnosti ili Prvi Soddyev zakon.
Drugi zakon radioaktivnosti
Drugi zakon govori o beta izdanje. Kada atom emitira beta česticu, koja se sastoji od elektrona i zanemarive mase, njegova atomska masa ostaci nepromijenjena to je tvoje atomski broj povećava se za jednu jedinicu. Općenito predstavljamo sljedeće:
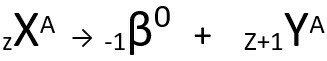
Generička jednadžba drugog zakona radioaktivnosti.
Pogledajte primjer:
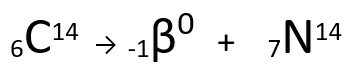
Jednadžba koja predstavlja emisiju β-čestica ugljikom-14.
Vidi se da nastali atom dušika ima istu masu kao i atom C-14, odnosno jesu izobare, a njegov atomski broj povećava se za jednu jedinicu. Povećanje u atomski brojobjasnio je znanstvenik Henrico Fermi, koji je predložio da jedan od neutronima jezgre prolazi transmutaciju, prema sljedećoj jednadžbi, generirajući aelektron(emitirana beta čestica), a neutrino(subatomska čestica bez električnog naboja i mase,) i a proton(P).
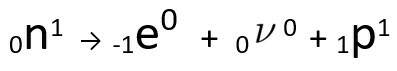
Jednadžba koja predstavlja neutronsku transmutaciju, prema Fermijevoj hipotezi.
O elektron to je neutrino izdaju se izvan jezgre, preostali samo protona, što objašnjava povećanje atomskog broja Da biste saznali više o njemu, idite na: Drugi zakon o radioaktivnosti ili Drugi zakon o Soddyju.
Pročitajte i vi: Razlika između radioaktivnog onečišćenja i zračenja
aplikacije
unatoč negativan pogled ima talog na radioaktivnost važne primjene u našem svakodnevnom životu, na primjer, u proizvodnja strujau nuklearne elektrane kroz fisijaradioaktivnih atoma.
Trenutno Brazil ne koristi nuklearna energija kao glavni izvor energije, ali nuklearne elektrane (Angra 1 i 2) rade za opskrbu zemlje električnom energijom. Također možemo spomenuti i datiranje materijala pronašli arheolozi koristeći ugljik-14.

Nuklearna elektrana Rio de Janeiro, Brazil
Sljedeća temeljna uloga koju radioaktivnost ima vezana je uz područje medicine, kao što je X-zrakai u CT skeniranje, a također i kod nekih vrsta liječenje karcinoma.
Pročitajte i vi: Glavni rizici nuklearne energije za okoliš
prirodna radioaktivnost
svakodnevno jesmo izloženi The male količine zračenja, bilo umjetnog ili prirodnog. Prirodna radioaktivnost spontano se javlja u prirodi. Dio ovog zračenja koje primamo dolazi iz hrane koja se svakodnevno konzumira, poput Radon-226 i Kalij-40, koji su predstavljeni u vrlo niske razine i ne predstavljaju rizik po naše zdravlje niti štete hranjivim vrijednostima hrane.
Namijenjen je ovom procesu izlaganja hrane radioaktivnim emisijama sačuvati hranu i promovirati a rast biljaka. Neki primjeri hrane koja emitira zračenje su: Brazilski orasi, banana, grah, crveno meso, između ostalog.
Otkriće
Proučavanje radioaktivnosti započelo je istraživanjem njemačkog fizičara Wilhelm Röentgen, 1895. godine, kada je istraživao učinakluminiscencija. Još jedan važan znanstvenik za razvoj radioaktivnosti bio je francuski fizičar Antoine-Henri Becquerel, koji je 1896. godine primijetio oznake na fotografskom filmu na uzorku uranove soli.
Međutim, to je bilo Par Curie koji je prvi put upotrijebio izraz radioaktivnost. U 1898, lak Marie Curie nastavio je proučavati radioaktivnost i otkrio vrijedna otkrića za to područje, poput otkrića dva nova radioaktivna elementa: polonija (Po) i radija (Ra).
Straga, Ernest Rutherford otkrio zračenje alfa tipa (α) i beta (β), koji je omogućio bolja objašnjenja svog atomskog modela, kao i napredak istraživanja povezanih s radioaktivnošću.
Pročitajte i vi:Marie Curie: biografija, prilozi i ostavština
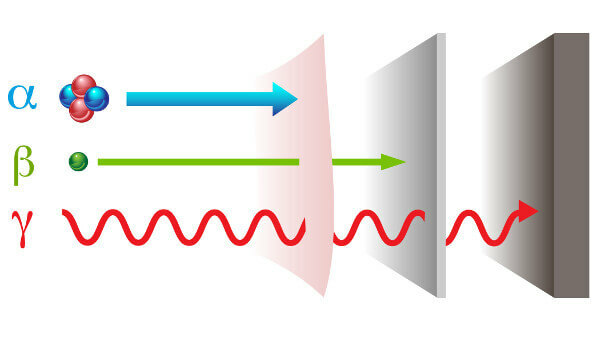
Vrste zračenja i njihove penetracijske moći.
propadanje
O radioaktivni raspad (ili transmutacija) je prirodni proces gdje jedan nestabilna jezgra emitira zračenje, sukcesivno, da bi snizite svoju energiju i postaju stabilni.
To se normalno događa s atomima atomskog broja. veći od 84, koji su atomi sa velika nestabilnost nuklearni zbog količine pozitivnog naboja (protona) nakupljenog u jezgri. U ovom procesu, neutroni nisu dovoljni kako bi se stabilizirali svi protoni skupljeni u jezgri, a zatim jezgra počinje prolaziti kroz radioaktivni raspad sve dok njezin atomski broj nije manji od 84.
U nekim se slučajevima može dogoditi da atomi s atomskim brojem manjim od 84 imaju nestabilne jezgre prolaze kroz proces raspadanja, ali za to trebaju imati broj protona znatno iznad broja neutronima.
Radioaktivni raspad je izračunato po poluživotu (ili razdoblje poluraspada, P) radioizotop, što je vrijeme potrebno da se polovina mase početnog radioaktivnog uzorka raspadne, odnosno postane stabilna. Grafički gledano, koncept poluživota predstavljen je u nastavku. Jer je to kontinuirani postupak, krivulja nastoji doseći nula.
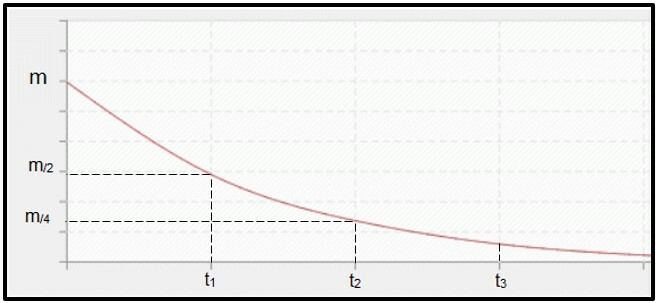
Grafikon koji predstavlja vrijeme poluraspada.
Izračuni koji uključuju radioaktivni raspad slijede sljedeće formule:
Formula za izračunavanje preostale mase nakon poluvijeka:
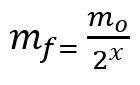
mf - završna masa
mO - početna masa
x - količina proteklih poluvremena
Formula za izračunavanje vremena raspadanja radioaktivnog uzorka:
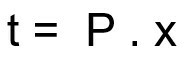
t - vrijeme raspadanja
P - razdoblje poluživota
x - količina proteklih poluvremena
radioaktivni elementi
Postoje dvije vrste radioaktivni elementi: ti prirodno i umjetno. Prirodni imaju elemente koji se nalaze u prirodi, već sa svojim nestabilnim jezgrama, poput urana, O aktinij to je radio. Umjetna se proizvode procesima koji destabiliziraju jezgru atoma. U ovom slučaju možemo spomenuti astatin to je francij.
Glavni radioaktivni elementi su: uran-235, kobalt-60, stroncij-90, radij-224 i jod-131. Zbog široke primjene u nuklearnim elektranama i liječenja karcinoma, ti se elementi često pojavljuju u našem svakodnevnom životu. Da biste saznali više o ovoj temi, idite na: radioaktivni elementi.
Radioaktivno smeće
Radioaktivni otpad odn nuklearni otpad to je talog od industrije koji koriste radioaktivni materijal u svojim procesima koji više nemaju praktičnu primjenu. Ovo smeće uglavnom dolazi iz nuklearne elektrane to je iz medicinske primjene.
Velika proizvodnja radioaktivnog otpada bila je problem okoliša za cijeli svijet, zbog oskudnih i neadekvatnih uvjeti zbrinjavanja i skladištenje.
Ova jalovišta povezana su s onečišćenjem tla, plovnih putova i zraka, što rezultira uništavanje okoliša postepeno. Osim toga, oni također predstavljaju rizike za ljudsko zdravlje, kao što su infekcije, Rak a u težim slučajevima onečišćenja mogu dovesti do smrt.
riješene vježbe
(PUC-Camp-SP) Atomska bomba, koja se naziva i nuklearna bomba, ima atomi urana-235 kao svoj dijeljivi sastojak, , alfa emiteri čestica
, alfa emiteri čestica  . Svaki atom U-235, kad emitira alfa česticu, pretvara se u drugi element čiji je atomski broj jednak
. Svaki atom U-235, kad emitira alfa česticu, pretvara se u drugi element čiji je atomski broj jednak
a) 231.
b) 233.
c) 234.
d) 88.
e) 90.
Predložak: Kada atom emitira alfa česticu, dolazi do smanjenja atomskog broja za dvije jedinice, prema prvom zakonu radioaktivnosti. Prema tome: 92-2 = 90. Slovo e.
(PUC-Camp-SP) Jod-125, radioaktivna sorta joda s medicinskom primjenom, ima poluvijek od 60 dana. Koliko će grama joda-125 ostati nakon šest mjeseci, na temelju uzorka koji sadrži 2,00 g radioizotopa?
a) 1,50
b) 0,75
c) 0,66
d) 0,25
e) 0,10
Predložak: Prvo se izračunava broj poluraspada proteklih tijekom 180 dana:
t = P. x
180 = 60. x
x = 3
Jednom kada se pronađe broj vremena poluraspada, izračunava se masa koja će ostati na kraju 180 dana:
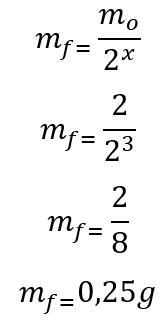
Stoga će na kraju šest mjeseci ostati 0,25 g radioizotopa joda-135. Slovo D.
Napisao Victor Felix
Diplomirao kemiju