Joseph Lous Gay-Lussac (1778. - 1850.) bio je znanstvenik koji je napravio važne studije plinova. Izvršio je proizvodnju vode iz reakcije između plinova vodika i kisika i potvrdio da su oni uvijek reagirao u omjeru dva volumena vodika i jednog volumena kisika, dajući dva volumena Voda:
Vodik + Kisik → Voda
1. pokus: 2 L 1 L 2 L
2. pokus: 4 L 2 L 4 L
3. pokus: 8 L 4 L 8 L
4. pokus: 16 L 8 L 160 L
Imajte na umu da je u svim eksperimentima omjer uvijek jednak: 2: 1: 2.
Nakon nekoliko pokusa i analiza, shvativši da se isto dogodilo i s drugim vrstama reakcija između plinova, odnosno reakcijama uvijek slijedeći konstantan omjer volumena, ovaj je znanstvenik došao do sljedećeg zakona reakcija u plinovitim volumenima, poznatog kao Gay-Lussac volumetrijski zakon ili Zakon o kombiniranju volumena:

Izjava volumetrijskog zakona Gay-Lussaca
Ali ovaj je zakon bio protiv Daltonova atomska teorija, koji je rekao da su sve tvorile masivne i nedjeljive sferne čestice, atomi. Prema ovoj teoriji, volumen produkata u reakciji trebao bi biti jednak zbroju volumena reaktanata. Stoga bi se trebalo dogoditi sljedeće:
Vodik + Kisik → Voda
2 sveska + 1 svezak → 3 sveska
Ali Gay-Lussac pokazao je da to nije slučaj u praksi, rezultat je jednak dvjema količinama vodene pare.
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Odgovor na ovu očitu kontradikciju došao je putem hipoteza ili Avogadrov zakon.

Marka tiskana u Italiji prikazuje Amedea Avogadra i objavu njegova zakona 1956. godine *
Amedeo Avogadro (1776.-1856.) Pokazali su da u stvarnosti plinovi nisu izolirani atomi, već molekule (s izuzetkom plemeniti plinovi). Njegov je zakon rekao:

Avogadrova pravna izjava
Avogadro je to pokazao 1 mol bilo kojeg plina ima 6.02. 1023 molekule. Ova je vrijednost poznata kao Avogadrov broj ili konstanta. Dokazano je da, u normalnim uvjetima temperature i tlaka (CNTP), u kojima je tlak jednak 1 atm, a temperatura 273 K (0 ° C), volumen koji zauzima 1 mol bilo kojeg plina uvijek će biti 22,4 L. Ova vrijednost odgovara molarni volumen plinova. Ti su odnosi vrlo važni za rješavanje vježbi stehiometrija.
To se može činiti čudnim, jer se može postaviti sljedeće pitanje: Kako plinovi s molekulama i atomima različitih veličina mogu zauzimati isti volumen?
Pa, to je zato što su molekule plina toliko udaljene da je veličina molekula zanemariva.
Na taj je način Avogadrov volumetrijski zakon objasnio Gay-Lussacov volumetrijski zakon. Imajte na umu da dvije molekule vodika (dva volumena) reagiraju s jednom molekulom kisika (jedan volumen) da bi stvorile dvije molekule vode (dva volumena). Voda i vodik imaju jednak volumen jer imaju jednaku količinu molekula, kako navodi Avogadrov zakon.
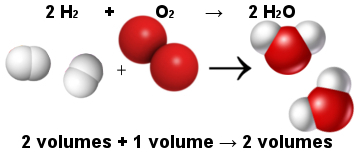
Udio između molekula u reakciji stvaranja vode
Istodobno, Avogadrov zakon natjerao je atomsku teoriju da stoji, jer vidite da i u reaktantima i proizvodima ima ukupno 6 atoma (4 vodika i 2 kisika).
Ovi volumetrijski zakoni bili su vrlo važni za razvoj koncepta molekule.
* Slika zaštićena autorskim pravima: rook76 / Shutterstock.com
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Gay-Lussacov volumetrijski zakon"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/lei-volumetrica-gay-lussac.htm. Pristupljeno 28. lipnja 2021.
Što su plinovi, koja su svojstva plinova, molekularni spojevi, stišljivost, fiksni volumen, kinetička energija srednja vrijednost, apsolutna temperatura plina, idealni plin, stvarni plinovi, savršeni plin, varijable stanja plina, zapremina plina, godišnja doba
Kemija

Gay-Lussacovi zakoni, Proustov zakon, Kemijske reakcije, Konstantni udio, mase tvari, čista tvar, analiza kvalitativni i kvantitativni, zakon savršenih plinova, zakon stalnih proporcija, zakon određenih proporcija, zakon volumetrijski.