THE Elektrokemija je grana Fizičke kemije koja proučava reakcije u kojima postoji prijenos elektrona (oksi-redukcijske reakcije) i njihove pretvorba u električnu energiju, kao i suprotan postupak, odnosno pretvorba električne energije u energiju kemija.
Prvi proces je ono što se odvija u Baterije. Baterije su uređaji koje uz elektrolit (provodnu otopinu) čine dvije elektrode (pozitivni pol, koji je katoda, i negativni pol, koji je anoda). Elektroni se vanjskim vodičem prenose s anode na katodu, tvoreći električnu struju koja se koristi za uključivanje nekog uređaja. Baterije se sastoje od nekoliko ćelija povezanih serijski ili paralelno.
To je spontan proces i energija se opskrbljuje sve dok se kemijska reakcija ne iscrpi (kao što je slučaj s primarnim stanicama i baterijama, poput Leclanchéove suhe ćelije i baterije alkalna), ili se u slučaju reverzibilnih reakcija može primijeniti razlika potencijala i reakcija se obrnuti, ponovno formirajući reaktante i dopunjavajući bateriju koja spreman je za ponovnu upotrebu (ovo je slučaj baterija i sekundarnih baterija, kao što su olovo, koje se koriste u automobilima i litij-ionske, koje se koriste u uređajima Mobiteli).

Primarne ćelije i baterije u prvom planu, a u drugom punjenje sekundarnih baterija (olovo i litij-ion)
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Obrnuti postupak nije spontan i naziva se elektroliza. Elektroliza je prolazak električne struje koja dolazi od generatora, poput ćelije ili baterije, kroz ionsku tekućinu. Ako je tekućina neka rastaljena tvar, imamo a magmatska elektroliza, ali ako se radi o vodenoj otopini, imamo vodena elektroliza.
Prilikom prolaska električne struje preko tekućeg medija, generator "izvlači" elektrone iz pozitivnog pola (anoda - ona je suprotna od baterija) elektrolitske ćelije i prenosi ih na negativni pol (katodu), tj. katoda prolazi kroz redukciju, a anoda prolazi kroz oksidacija. Dakle, električna energija koju isporučuje generator pretvara se u redoks reakcije (kemijska energija). Ispod je shema elektrolize vode:
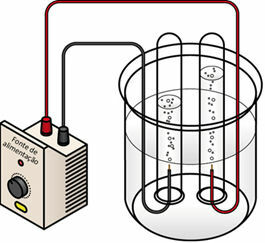
Shema elektrolize vode
Elektroliza se široko primjenjuje industrijski u proizvodnji važnih tvari, kao što su aluminij, plinoviti klor, metalni natrij, te za pročišćavanje ili zaštitu različitih metala, kao u postupcima galvanizacije ili galvanizacije koji se sastoje u presvlačenju nekog predmeta metalom, poput srebrenjavanja, bakrenjanja, niklovanja, pozlate i kromiranje; kada je čelik obložen cinkom, to se naziva pocinčavanje.
U odjeljku Elektrokemija na našoj web stranici pronaći ćete više detalja o svim aspektima koji se odnose na ćelije i baterije, kao i na elektrolizu.
Napisala Jennifer Fogaça
Diplomirao kemiju
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
FOGAÇA, Jennifer Rocha Vargas. "Što je elektrokemija?"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletroquimica.htm. Pristupljeno 27. lipnja 2021.
Kemija

Elektroliza, otopine elektrolita, električna struja, reakcije redukcije oksidacije, spontani kemijski postupak, kemijski postupak nespontan, transformator, umjetna transformacija, industrije, alkalni metali, zemnoalkalna zemlja, plinoviti vodik, plin kl
