Plin i para
Razlika između plina i pare daje se od kritične temperature. Para je tvar u plinovitom stanju, stanje koje se može ukapliti s povećanim pritiskom. Plin nije isto. To je tekućina koja se ne može ukapiti jednostavnim povećanjem tlaka. Zbog toga se plin razlikuje od pare.
Ponašanje plinova
Dana tvar u plinovitom stanju je plin ako je temperatura viša od kritične temperature, ako je temperatura jednaka ili niža od kritične temperature tvar je para.
Stvarni plinovi koje inače poznajemo, poput helija, dušika i kisika, imaju različite i posebne molekularne karakteristike svakog od njih. Međutim, ako ih sve stavimo na visoke temperature i niske pritiske, počinju pokazivati vrlo slično ponašanje. U proučavanju plinova usvojen je jednostavan teorijski model koji u praksi ne postoji, a ponašanje je slično ponašanju stvarnih plinova. Ova aproksimacija postaje bolja što su niži tlak i viša temperatura. Ovaj model plina se naziva savršeni plin.
Otprilike u 17. i 19. stoljeću trojica znanstvenika (Jacques Charles, Louis J. Gay-Lussac i Paul E. Clayperon), nakon proučavanja ponašanja plinova, razradio zakone koji reguliraju ponašanje savršenih plinova, također nazvanih idealnim plinovima. Zakoni koje su oni odredili uspostavljaju pravila "vanjskog" ponašanja savršenog plina, što dovodi do broji samo fizičke veličine koje su s njima povezane, a to su: volumen, temperatura i pritisak.
Opći zakon savršenih plinova
Izraz koji određuje opći zakon za savršene plinove može se vidjeti kako slijedi:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
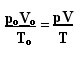
gdje je strO, VO i TO jesu početni tlak, početni volumen i početna temperatura. Ovo je izraz koji se koristi kada se varijable plina razlikuju.
Boyleov zakon
Robert Boyle, fizičar i kemičar, bio je taj koji je odredio zakon koji regulira pretvorbe podvrgnute plinu, kada se njegova temperatura održava konstantnom. Njegov zakon kaže da kada je plin podvrgnut izotermičkoj transformaciji, njegov tlak je obrnuto proporcionalan zauzetom volumenu. Iz ovog zakona dobivamo kako TO = T Mi moramo:
StrOVO = pV
Charlesov zakon
Charlesov zakon je zakon koji uređuje transformacije savršenog plina u konstantni volumen. Te se transformacije nazivaju izohorne ili izometrijske transformacije. Prema ovom zakonu, kada savršena plinska masa prođe izohornu transformaciju, njezin je tlak izravno proporcionalan apsolutnoj temperaturi. Matematički se ovaj zakon može izraziti na sljedeći način:

gdje je strO i TO jesu početni tlak odnosno početna temperatura.
Gay-Lussacov zakon
Gay-Lussacov zakon je zakon koji uređuje transformacije savršenog plina pod stalnim tlakom. Ovaj zakon, unatoč tome što je nosio ime Gay-Lussac, već je otkrio fizičar i kemičar A.C. Charles. Prema zakonu, kada plin prođe izobarnu transformaciju, volumen plina je izravno proporcionalan njegovoj apsolutnoj temperaturi. Matematički se ovaj zakon može izraziti na sljedeći način:

Gdje je VO i TO odgovaraju početnom volumenu i početnoj temperaturi.
Napisao Marco Aurélio da Silva
Vidi više!!
Transformacije plina
Znajte što su transformacije plina.
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
SANTOS, Marco Aurélio da Silva. "Proučavanje plinova"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Pristupljeno 27. lipnja 2021.