Kad podvrgnemo različite elemente djelovanju plamena, primijetimo da svaki od njih emitira drugačiju boju. Na primjer, ako sagorijevamo stroncij, natrij i bakrenu sol, vidjet ćemo red boje, intenzivno žutu i zelenu, kao što je prikazano na sljedećoj slici:

Ako svjetlost iz ovog plamena padne na prizmu, a diskontinuirani spektar, to jest, primijetit će se samo nekoliko obojenih svijetlih linija prošaranih regijama bez svjetla. Za svaki element imat ćemo drugačiji spektar.

Ovakve se vrste spektra nazivaju spektar emisije, jer ih je izdao određeni element i služe za njegovo identificiranje.
Ovakve spektre moguće je dobiti pomoću svjetlosne zrake proizvedene u visokotlačnoj cijevi za električno pražnjenje temperature i niski tlakovi, koji sadrže plinove iz određenih elemenata poput vodika ili plemenite plinove dolje:

Propuštanjem ovog elektromagnetskog zračenja (svjetlosti) proizvedenog kroz prizmu dobivaju se emisijski spektri svakog od ovih elemenata.
Prije se mislilo da je postignuti sunčev spektar potpuno kontinuiran, ali engleski znanstvenik William Hyde Wollaston otkrio je da je do radeći s vrlo uskim snopom svjetlosti, s prorezom od oko 0,01 mm, mogli ste vidjeti da sunčev spektar sadrži sedam crnih linija o tome. Kasnije, mladi
Joseph Fraunhofer (1787.-1826.), Koristeći prizme i difrakcijske rešetke, otkrio je da sunčev spektar zapravo sadrži tisuće crnih crta koje se preklapaju.Nešto kasnije i fizičko Gustav Robert Kirchhoff primijetio je da su se žute mrlje, postignute natrijevim spektrom, nalazile na potpuno istom mjestu kao dvije crne linije u sunčevom spektru. on i kemičar Robert Wilhelm Bunsen izveo nekoliko eksperimenata i primijetio da ako bijela svjetlost iz Bunsenovog plamenika, poput sunčeve svjetlosti, prolazi pored žute svjetlosti koju emitira natrij i kroz prizmu se prelazi da bi se dobio spektar; rezultat bi bio kontinuirani sunčev spektar, u duginim bojama, ali s crnim crtama (Fraunhofer ih je nazvao D linijama) u istom položaju kao i žutim crtama u natrijevom spektru.
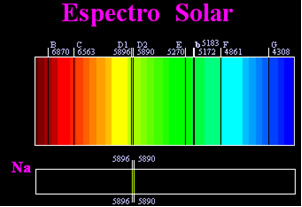
Sunce emitira svjetlost svih boja, od crvene do ljubičaste, međutim, prolazeći kroz Zemljinu atmosferu, prisutni plinovi upijaju sunčevu svjetlost točno u bojama koje emitiraju.
Ovakve se vrste spektra nazivaju apsorpcijski spektri.
Na temelju ovih opažanja, Kirchoff stvorio tri zakoni za spektroskopiju, a to su:
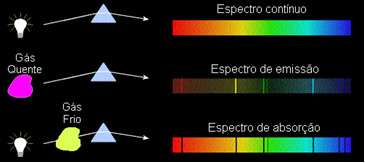
1) Tijelo neproziran vruće, u bilo kojem od tri fizička stanja, emitira spektar stalan.
2) Plin transparentan - poput onih od plemenitih plinova koje smo vidjeli gore - proizvodi a spektar emisije, s pojavom linije svijetao. Broj i položaj ovih vodova odredit će se kemijskim elementima koji su prisutni u plinu.
3) Ako a kontinuirani spektar prolazi kroz plin na najnižoj temperaturi hladni plin uzrokuje prisutnost tamne crte, to je spektar apsorpcije. To se dogodilo sa spektrom sunčeve svjetlosti koja prolazi kroz plin natrij. U ovom slučaju, broj i položaj linija u spektru apsorpcije također ovise o kemijskim elementima prisutnim u plinu.
Napisala Jennifer Fogaça
Diplomirao kemiju
Izvor: Brazil škola - https://brasilescola.uol.com.br/quimica/espectros-emissao-absorcao-leis-kirchhoff.htm


