Pojmovi reverzibilnih i nepovratnih procesa mogu se matematički opisati pomoću koncepta entropije. No prije nego što dođemo do definicije entropije, dođimo do pojmova reverzibilnih i nepovratnih procesa. mi zovemo reverzibilni postupak onaj u kojem se sustav može spontano vratiti u prvobitnu situaciju (ili stanje). Nepovratan postupak je onaj čiji se sustav ne može spontano vratiti u prvobitno stanje.
Kako su pojmovi vrsta procesa već spomenuti, idemo na definiciju entropije. THE entropija sustava (S) mjera je njegovog stupnja neorganiziranosti. Što je organizacija veća, entropija je niža. Entropija je karakteristika termodinamičkog stanja, kao i unutarnja energija, volumen i broj madeža.
Gledajući spremnike na gornjoj slici, vidimo da spremnik 1 ima a entropija manja od druge. Ako uzmemo posudu i protresemo je, provjerit ćemo da li će "kuglice" biti izmiješane ili bolje rečeno neorganizirane. Ako provjerimo posudu 2, nakon što smo je protresli, primijetit ćemo da loptice nisu moguće, spontano, vratite se svojoj izvornoj organizaciji, ako nastavimo drmati kontejner.
U reverzibilnim izotermnim (čija temperatura uvijek ostaje ista) reverzibilnim procesima, entropiju definiramo kao omjer topline (dane ili primljene) i temperature. Dakle, entropiju u izotermnim procesima predstavljamo na sljedeći način:
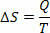
U međunarodnom sustavu jedinica mjerimo entropiju u džulima / kelvinima. Na temelju koncepta koji opisujemo o entropiji, Drugi zakon možemo formulirati na sljedeći način:

Promjena entropije izoliranog sustava uvijek je pozitivna ili ništavna. Jednakost ΔS = 0 javlja se kad su procesi reverzibilni: reverzibilni procesi ne povećavaju entropiju. Izoliranim sustavima, koji niti primaju niti daju toplinu okolišu, entropija se može samo povećati ili održati konstantnom.
Napisao Domitiano Marques
Diplomirao fiziku
Brazilski školski tim
Izvor: Brazil škola - https://brasilescola.uol.com.br/fisica/entropia-segunda-lei.htm



