THE molekularna geometrija, odnosno raspored atoma molekule, može se odrediti kemijskim pravilom Gillespie, u kojem navodi broj atoma vezanih uz središnji atom i broj oblaka elektronika.
Znanje o geometriji molekule izuzetno je važno jer nam pomaže odrediti polaritet i, posljedično, topljivost (prema pravilu slično otapa sličan).
uz poziv tetraedarska geometrija, nije ništa drugačije. Pogledajte kriterije za njegovo određivanje prema Gillespiejevim pravilima:
Pentatomske molekule (pet atoma);
Odsutnost elektroničkih oblaka u središnjem atomu;
kompozitne molekule ili složeni anioni.
Neki primjeri molekula čija je geometrija tetraedarska oni su:
CH4

CH strukturna formula4
Ugljik ima četiri elektrona u svojoj valentnoj ljusci i svi se ti elektroni vežu s vodikovima. Zato ugljik nema elektronički oblak (dodatni par elektrona).
SAMO4-2
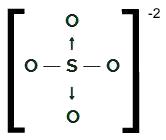
OS strukturna formula4-2
Sumpor, koji ima šest elektrona u valentnoj ljusci, stvara dvije jednostruke veze s dva atoma kisika i dva dativne kovalentne veze s druga dva kisika. U pojedinačnim vezama koristi dva svoja elektrona, a u svakom dativu koristi još dva (ukupno četiri elektrona koja su uključena u dative), ukupno šest elektrona. Kao takav, nema oblaka više.
NH4+

NH strukturna formula4+
Dušik, koji ima pet elektrona u valentnoj ljusci, stvara tri jednostruke veze s atomima vodika i dativnu vezu s drugim vodikom. U pojedinačnim vezama koristi tri svoja elektrona, a u dativu još dva, ukupno pet elektrona. Kao takav, nema oblaka više.
CH3Kl
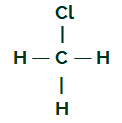
CH strukturna formula3Kl
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Ugljik ima četiri elektrona u svojoj valentnoj ljusci i svi se ti elektroni vežu s vodikovima i atomom klora. Iz tog razloga ugljik nema elektronički oblak.
→ Polaritet molekula
Znajući da data molekula ima tetraedarsku geometriju, možemo odrediti njezin polaritet od izuzetno jednostavan oblik, jer molekula zauzima svoja četiri pola (četiri liganda u atomu središnji). Za to je dovoljno znati karakteristike veziva i uzeti u obzir jedno od sljedećih pravila:
Ako je broj oblaka jednak broju jednakih liganda = nepolarna molekula;
Ako se broj oblaka razlikuje od broja jednakih liganda = polarna molekula.
U sljedeće dvije molekule, čija je geometrija tetraedarska, možemo primijeniti gornja pravila i naznačiti njihovu polarnost:
Molekula metana
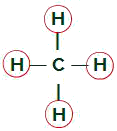
Jednaki ligandi u molekuli metana
Molekula metana ima četiri oblaka elektrona (četiri jednostruke veze) i također četiri atoma vodika vezana za središnji atom. Tako, imamočetirioblaci i četiri jednaka veziva, uskoro, molekula je nepolarna.
Promatranje: Ako je molekula supstance apolate, dobro se otapa u drugoj supstanci čije su molekule također nepolarni.
Molekula klorometana

Jednaki ligandi u molekuli klorometana
Molekula klorometana ima četiri oblaka elektrona (četiri jednostruke veze) i tri atoma vodika i jedan atom klora spojen na središnji atom. Tako, imamočetirioblaci i tri jednaka liganda (tri vodika); uskoro, molekula je polarna.
Promatranje: Ako je molekula supstance polarni, dobro se otapa u drugoj supstanci čije su molekule također polarni.
Ja, Diogo Lopes Dias
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
DANI, Diogo Lopes. "Tetraedarska geometrija"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/quimica/geometria-tetraedrica.htm. Pristupljeno 28. lipnja 2021.