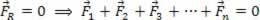U izovolumetrijskim procesima volumen ostaje konstantan i stoga se ne izvodi nikakav rad. Toplina izmjenjena s medijem jednaka je promjeni unutarnje energije sustava (vidi grafikon gore).
Prema prvom zakonu termodinamike, u bilo kojem termodinamičkom procesu količina topline P primljen od sustava jednak je radu koji je obavio plus varijaciji njegove unutarnje energije. Dakle, jednadžba koja predstavlja prvi zakon slijedi u nastavku:
Q = τ + ∆U
Kao što je rečeno u prvom stavku, gdje se kaže da nema posla, moramo τ=0. Dakle, izmjenjena toplina s medijem jednaka je povećanju unutarnje energije sustava. Dakle, imamo:
Ne zaustavljaj se sada... Ima još toga nakon oglašavanja;)
Q = ∆U
Kada se u sustav dovede toplina, odnosno kada P je pozitivno, unutarnja energija će se povećati; i kada sustav izgubi toplinu, odnosno kada P je negativan, unutarnja energija će se smanjivati. Procesi s konstantnim volumenom događaju se kada je spremnik koji sadrži materijal kruti (npr. Plinska boca).
Kada prima toplinu, sustav ima tendenciju širenja, ali ga ometaju zidovi posuda, pa se tlak i temperatura sustava povećavaju.
Napisao Domitiano Marques
Diplomirao fiziku
Želite li uputiti ovaj tekst u školskom ili akademskom radu? Izgled:
SILVA, Domitiano Correa Marques da. "Prvi zakon za izovolumetrijske procese"; Brazil škola. Dostupno u: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isovolumetricos.htm. Pristupljeno 27. lipnja 2021.