परमाणु अध्ययन की जटिलताओं के बीच परमाणु के आकार का निर्धारण करना या, बेहतर, परमाणु किरण. यह आवधिक गुण नाभिक से उसके इलेक्ट्रॉनिक स्तरों के सबसे बाहरी इलेक्ट्रॉन तक की दूरी का वर्णन करता है। इसे निर्धारित करने के लिए, उदाहरण के लिए, एक साधारण पदार्थ बनाने वाले दो परमाणुओं के नाभिक के बीच की दूरी का अंकगणितीय औसत किया जाता है।
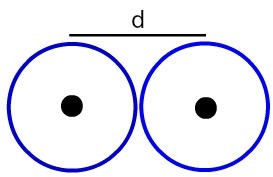
दो परमाणु नाभिकों के बीच की दूरी का प्रतिनिधित्व
आइए निर्धारित करें परमाणु त्रिज्या (आरए) छवि में उदाहरण परमाणुओं की। ऐसा करने के लिए, बस कोर के बीच की दूरी को 2 से विभाजित करें:
आरए = घ
2
हे परमाणु किरण अध्ययन महत्वपूर्ण है क्योंकि यह कुछ भौतिक घटनाओं (घनत्व, बिंदु .) की समझ का पक्षधर है संलयन, क्वथनांक और आयनीकरण ऊर्जा) और रसायन (रासायनिक बंधन) जो के साथ होते हैं परमाणु।
एक आवर्त सारणी का विश्लेषण करके, हम यह आकलन कर सकते हैं कि एक परमाणु दूसरे के संबंध में बड़ा है या छोटा, और इस प्रकार निर्धारित करें कि उनके कक्षकों से एक या एक से अधिक इलेक्ट्रॉनों को निकालने में इसकी अधिक या कम आसानी है या नहीं। आवर्त सारणी में परमाणु त्रिज्या का मूल्यांकन और निर्धारण दो बुनियादी मानदंडों के अनुसार किया जाता है:
क) ऊर्जा स्तरों की संख्या (परिवार या समूह/ऊर्ध्वाधर स्तंभ)
हम जानते हैं कि परमाणुओं में सात ऊर्जा स्तर (के, एल, एम, एन, ओ, पी, क्यू) हो सकते हैं और प्रत्येक रासायनिक तत्व परिवारों या समूहों (ऊर्ध्वाधर स्तंभों) और आवर्त (स्तंभों) में स्थित होता है क्षैतिज)। आवर्त परमाणु के स्तर की संख्या को इंगित करता है, और परिवार परमाणु के सबसे ऊर्जावान उप-स्तर को इंगित करता है। एक समूह या परिवार में, रासायनिक तत्व ऊर्जा स्तरों की मात्रा से भिन्न होते हैं। नीचे दी गई तालिका देखें:

किसी परमाणु के ऊर्जा स्तरों की संख्या जितनी अधिक होगी, उसकी परमाणु त्रिज्या उतनी ही अधिक होगी। ऊपर दी गई तालिका का विश्लेषण करने पर यह देखा जा सकता है कि फ्रांसियम में सबसे बड़ा परमाणु होता है क्योंकि इसके सात स्तर होते हैं। दूसरी ओर, पोटेशियम परमाणु का दायरा छोटा होता है क्योंकि इसमें चार ऊर्जा स्तर होते हैं। फ्रांसियम परमाणु और पोटेशियम परमाणु के बीच एक तुलनात्मक प्रतिनिधित्व निम्नलिखित है:
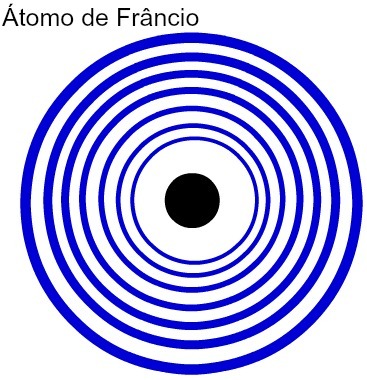
फ्रांसियम परमाणु के सात ऊर्जा स्तरों का प्रतिनिधित्व
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)

पोटेशियम परमाणु के चार ऊर्जा स्तरों का प्रतिनिधित्व
निम्नलिखित आरेख यह दर्शाता है कि आवर्त सारणी के एक ही परिवार या समूह (ऊर्ध्वाधर स्तंभ) में परमाणु त्रिज्या में वृद्धि कैसे होती है। स्तरों की संख्या जितनी अधिक होगी, त्रिज्या उतनी ही अधिक होगी, आवर्त सारणी पर, परमाणु त्रिज्या ऊपर से नीचे की ओर बढ़ती है:
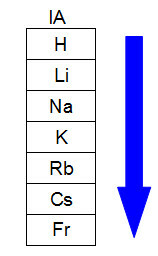
आवर्त सारणी परिवार में परमाणु त्रिज्या कैसे बढ़ती है इसका प्रतिनिधित्व
बी) समान अवधि (क्षैतिज स्तंभ) में परमाणु संख्या (जेड या प्रोटॉन की संख्या)
जब रासायनिक तत्व समान अवधि के होते हैं, तो उनके परमाणुओं में समान मात्रा में ऊर्जा स्तर होते हैं, लेकिन उनके नाभिक के अंदर प्रोटॉन की मात्रा भिन्न होती है। निम्नलिखित आवर्त सारणी के चौथे आवर्त से संबंधित तत्वों का एक क्रम है:
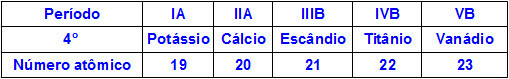
उपरोक्त तालिका में दर्शाए गए तत्वों के सभी परमाणुओं में चार ऊर्जा स्तर होते हैं, लेकिन उनमें से प्रत्येक के नाभिक में अलग-अलग मात्रा में प्रोटॉन होते हैं। चूंकि नाभिक के अंदर के प्रोटॉन ऊर्जा स्तरों में मौजूद इलेक्ट्रॉनों पर एक आकर्षक बल लगाते हैं, नाभिक में प्रोटॉन की मात्रा जितनी अधिक होगी, इलेक्ट्रॉनों के प्रति उनका आकर्षण उतना ही अधिक होगा. परिणाम परमाणु के आकार को कम करते हुए, नाभिक की ओर स्तरों का एक सन्निकटन है।
↑Z = परमाणु त्रिज्या
↓Z = परमाणु त्रिज्या
इस प्रकार, हम कह सकते हैं कि प्रोटॉन की कम संख्या के कारण पोटेशियम तत्व की परमाणु त्रिज्या वैनेडियम की तुलना में अधिक है।
निम्न आरेख दर्शाता है कि समान अवधि (क्षैतिज रेखा) में परमाणु त्रिज्या कैसे बढ़ती है। परमाणु क्रमांक जितना छोटा होगा, त्रिज्या उतनी ही बड़ी होगी, यानी तालिका में परमाणु त्रिज्या दाएं से बाएं बढ़ती है
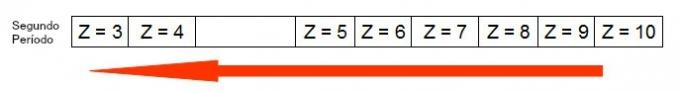
आवर्त सारणी के आवर्त में परमाणु त्रिज्या कैसे बढ़ती है इसका प्रतिनिधित्व
मेरे द्वारा। डिओगो लोपेज दीया
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
DAYS, डिओगो लोपेज। "परमाणु का आधा घेरा"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/raio-atomico.htm. 28 जून, 2021 को एक्सेस किया गया।