प्रत्येक कोशिका एक उपकरण है जिसमें एक स्वतःस्फूर्त ऑक्सीकरण-कमी प्रतिक्रिया होती है जो एक विद्युत प्रवाह उत्पन्न करती है, जो बदले में, कुछ उपकरणों को काम करने के लिए उपयोग किया जाता है।
इन उपकरणों को उनका नाम इसलिए मिला क्योंकि पहली बैटरी का आविष्कार एलेसेंड्रो ने किया था वर्ष 1800 में वापस, यह जस्ता और तांबे की डिस्क द्वारा बनाई गई थी जिसे कपास में भिगोकर अलग किया गया था नमकीन। इस सेट को आपस में एक दूसरे के ऊपर एक करके रखा गया था, जमा डिस्क और एक बड़ा स्तंभ बनाने। कैसा था बैटरी डिस्क का, उस नाम से पुकारा जाने लगा।

बैटरियां हमेशा दो इलेक्ट्रोड और एक इलेक्ट्रोलाइट से बनी होती हैं. सकारात्मक इलेक्ट्रोड को कहा जाता है a कैथोड और यहीं पर की प्रतिक्रिया होती है कमी. ऋणात्मक इलेक्ट्रोड है एनोड और यहीं पर की प्रतिक्रिया होती है ऑक्सीकरण. इलेक्ट्रोलाइट भी कहा जाता है सॉल्ट ब्रिज और आयन-चालक विलयन है।
आपके लिए यह समझने के लिए कि यह विद्युत प्रवाह कैसे उत्पन्न करता है, पहली बैटरी में से एक का मामला देखें, डेनियल का ढेर, जिसमें कॉपर सल्फेट (CuSO .) के घोल वाला एक कंटेनर था4(एक्यू)) और, उस घोल में डूबा हुआ, एक तांबे की प्लेट थी। एक अन्य अलग कंटेनर में जिंक सल्फेट (ZnSO .) का घोल था
4(एक्यू)) और एक डूबा हुआ जस्ता प्लेट। दो समाधान एक नमक पुल से जुड़े हुए थे, जो पोटेशियम सल्फेट समाधान (के .) के साथ एक ग्लास ट्यूब था2केवल4(एक्यू)) सिरों पर कांच के ऊन के साथ। अंत में, दो प्लेटों को एक बाहरी सर्किट द्वारा एक लैंप के साथ आपस में जोड़ा गया, जिसका प्रकाश विद्युत प्रवाह के पारित होने का संकेत देगा: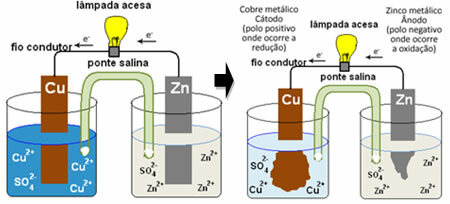
क्या होता है कि जस्ता में ऑक्सीकरण करने की अधिक प्रवृत्ति होती है, यानी इलेक्ट्रॉनों को खोने के लिए, इसलिए ब्लेड का धातु जस्ता नकारात्मक इलेक्ट्रोड, एनोड के रूप में काम करता है, जहां ऑक्सीकरण होता है: Zn(एस) Zn2+(यहां) + 2 और-. जस्ता द्वारा खोए गए इलेक्ट्रॉनों को बाहरी सर्किट द्वारा तांबे में ले जाया जाता है, जिससे विद्युत प्रवाह उत्पन्न होता है जो दीपक को चालू करता है। विलयन में कॉपर आयन इलेक्ट्रॉन प्राप्त करते हैं (कम करते हैं) और तांबे की शीट पर जमा होने वाले धात्विक तांबे में बदल जाते हैं। इसका मतलब है कि यह सकारात्मक इलेक्ट्रोड, कैथोड है, जहां कमी होती है: नितंब2+(यहां) + 2 और- गधा(एस)।
आज की बैटरियों में एक ही ऑपरेटिंग सिद्धांत है, जिसमें एक धातु एक प्रवाहकीय समाधान के माध्यम से दूसरे को इलेक्ट्रॉनों का दान करती है, और एक विद्युत प्रवाह उत्पन्न होता है। अंतर यह है कि आज इस्तेमाल की जाने वाली बैटरियां सूखी हैं, क्योंकि वे इलेक्ट्रोलाइट के रूप में तरल घोल का उपयोग नहीं करती हैं, जैसा कि डेनियल की बैटरी में होता है।
आज बैटरियों की एक बहुत विस्तृत विविधता है जो व्यावसायिक रूप से बेची जाती हैं। उनमें से सबसे आम हैं एसिड कोशिकाएं (लेक्लांच से) और यहक्षारीय बैटरी.
दोनों में नकारात्मक इलेक्ट्रोड के रूप में जस्ता है; दूसरी ओर, एक धनात्मक ध्रुव के रूप में, मैंगनीज डाइऑक्साइड (MnO) से घिरे ढेर के बीच में एक ग्रेफाइट बार स्थापित होता है2), पाउडर चारकोल (सी) और एक गीला पेस्ट। अंतर यह है कि, एसिड ढेर में, गीले पेस्ट में अमोनियम क्लोराइड (एनएच) का उपयोग किया जाता है।4Cl) और जिंक क्लोराइड (ZnCl .)2) - अम्लीय प्रकृति के लवण - पानी के अलावा (H .)2ओ)। क्षारीय बैटरी में पोटेशियम हाइड्रॉक्साइड (KOH), जो एक क्षार है, का उपयोग किया जाता है।

Leclanché बैटरी उन उपकरणों के लिए सबसे उपयुक्त हैं जिन्हें प्रकाश और निरंतर निर्वहन की आवश्यकता होती है, जैसे रिमोट कंट्रोल, वॉल क्लॉक, पोर्टेबल रेडियो और खिलौने। दूसरी ओर, क्षारीय बैटरियों में समान आकार की सामान्य बैटरी की तुलना में 50 से 100% अधिक ऊर्जा होती है, जिसकी अनुशंसा उन उपकरणों के लिए की जाती है जो रेडियो, सीडी/डीवीडी प्लेयर, पोर्टेबल एमपी3 प्लेयर, फ्लैशलाइट, डिजिटल स्टिल कैमरा जैसे तेज और अधिक तीव्र डाउनलोड की आवश्यकता होती है आदि।

इन और अन्य प्रकार की बैटरियों में किस प्रकार के इलेक्ट्रोलाइट्स और इलेक्ट्रोड का उपयोग किया जाता है, इसके बारे में और जानें। किस प्रकार के उपकरणों के लिए उनकी सबसे अधिक अनुशंसा की जाती है, संबंधित लेख और अधिक पढ़ें बोलो।
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
