अमेरिकी रसायनज्ञ गिल्बर्ट एन। लुईस (1875-1946) ने अष्टक नियम का प्रस्ताव रखा, जो कहता है:
"विभिन्न तत्वों के परमाणु इलेक्ट्रॉनिक विन्यास प्राप्त करने के लिए रासायनिक बंधन स्थापित करते हैं, इलेक्ट्रॉनों को दान, प्राप्त या साझा करते हैं" नोबल गैस, यानी अंतिम शेल में 8 इलेक्ट्रॉनों के साथ (या उन परमाणुओं के मामले में 2 इलेक्ट्रॉनों के साथ जिनमें केवल एक इलेक्ट्रॉन शेल होता है, जैसा कि हाइड्रोजन)।"
1916 में, लुईस ने सुझाव दिया कि स्थिर रहने के लिए, अष्टक या युगल तक पहुँचने के लिए, वे तत्व जो इसे बनाते हैं आणविक पदार्थ इलेक्ट्रॉन जोड़ी साझा करना। ये पदार्थ केवल के परमाणुओं से बनते हैं हाइड्रोजन, गैर-धातु और अर्ध-धातु, सभी के साथ इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति. इसलिए, उनमें से किसी के लिए भी कोई इलेक्ट्रॉन दान करने का कोई तरीका नहीं है (जैसा कि आयनिक बंधों में धातुओं के साथ होता है), लेकिन सभी को प्राप्त करने की आवश्यकता होती है, इसलिए वे अपने इलेक्ट्रॉनों को एक सहसंयोजक बंधन के माध्यम से साझा करते हैं या आणविक।
इस प्रकार, गिल्बर्ट लुईस ने सहसंयोजक या आणविक बंधन का प्रतिनिधित्व करने का एक तरीका प्रस्तावित किया, जिसे. के रूप में जाना जाने लगा
लुईस सूत्र. उसे भी कहा जाता है इलेक्ट्रॉनिक सूत्र या फिर भी, लुईस का इलेक्ट्रॉनिक सूत्र, क्योंकि इसकी मुख्य विशेषता यह है कि यह प्रत्येक परमाणु के संयोजकता कोश में इलेक्ट्रॉनों और इलेक्ट्रॉनिक युग्मों के बनने को दर्शाता है।प्रत्येक इलेक्ट्रॉन को एक बिंदु द्वारा दर्शाया जाता है।, जो संबंधित रासायनिक तत्व के प्रतीक को घेरता है। तत्व के चारों ओर केवल संयोजकता कोश इलेक्ट्रॉन होते हैं।
जैसा कि नीचे दी गई तालिका में दिखाया गया है, संयोजकता कोश में इलेक्ट्रॉनों की मात्रा जानने के लिए, बस आवर्त सारणी परिवार को जानें:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)

लुईस सूत्र में, प्रत्येक साझा इलेक्ट्रॉन जोड़ी एक रासायनिक (सहसंयोजक) बंधन का प्रतिनिधित्व करती है, जहां इलेक्ट्रॉन इलेक्ट्रोस्फीयर के उस क्षेत्र में मिलते हैं जो एक साथ जुड़ने वाले परमाणुओं के प्रत्येक जोड़े के लिए सामान्य है। इसलिए, प्रतिनिधित्व में, उन्हें एक साथ रखा गया है।
उदाहरण के लिए, आइए जानें कि हाइड्रोजन गैस के लिए लुईस सूत्र क्या है, जिसका आणविक सूत्र है: H2.
प्रत्येक हाइड्रोजन परमाणु के संयोजकता कोश में केवल एक इलेक्ट्रॉन होता है, क्योंकि यह तत्व आवर्त सारणी के परिवार 1 से संबंधित है। K इलेक्ट्रॉन शेल में दो इलेक्ट्रॉनों के साथ, स्थिर होने के लिए प्रत्येक को एक और इलेक्ट्रॉन प्राप्त करने की आवश्यकता होती है। इसलिए वे अपने इलेक्ट्रॉनों को साझा करते हैं और दोनों को दो मिलते हैं। देखो:
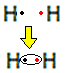
यह हाइड्रोजन गैस अणु के लिए लुईस सूत्र है।
ऑक्सीजन के इलेक्ट्रॉन खोल में छह इलेक्ट्रॉन होते हैं, इसलिए प्रत्येक को आठ इलेक्ट्रॉनों के साथ स्थिर होने के लिए दो और इलेक्ट्रॉन प्राप्त करने की आवश्यकता होती है। इसलिए, ऑक्सीजन गैस अणु के लिए लुईस सूत्र है:

देखें कि दो लिंक हैं, क्योंकि दो साझा जोड़े हैं।
आणविक पदार्थों के इलेक्ट्रॉनिक सूत्रों के अन्य उदाहरण नीचे देखें:
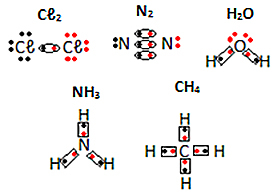
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
FOGAÇA, जेनिफर रोचा वर्गास। "लुईस इलेक्ट्रॉनिक फॉर्मूला"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/formula-eletronica-lewis.htm. 28 जून, 2021 को एक्सेस किया गया।
कार्बन का स्थानिक सूत्र, लुईस का इलेक्ट्रॉनिक सूत्र, समतल संरचना, इलेक्ट्रॉनिक जोड़े, बंधन सहसंयोजक, संयोजकता परत, परमाणु मॉडल का विकास, आणविक सूत्र, संरचनात्मक सूत्र, सूत्र formula त्रि-आयामी।
रासायनिक सूत्र, फ्लैट संरचनात्मक सूत्र, कूपर संरचनात्मक सूत्र, ट्रिपल बॉन्ड, गैस नाइट्रोजन, इलेक्ट्रॉनिक सूत्र, लुईस सूत्र, आणविक सूत्र, एकल बंधन, दोहरा बंधन, गैस कार्बनिक
रसायन विज्ञान
आणविक पदार्थ, क्वथनांक, संपर्क सतह, क्वथनांक, अंतर-आणविक आकर्षण बल, रासायनिक बंधन, आणविक यौगिक, सहसंयोजक रासायनिक बंधन, आयनिक बंधन, धातु बंधन, भौतिक अवस्था खराब


