पदार्थ (परमाणु) के गठन के बारे में विचार प्राचीन ग्रीस में लगभग 450 ईसा पूर्व में उभरा। ए।, मुख्य रूप से डेमोक्रिटो और ल्यूसिपो से। हालांकि, परमाणु को वास्तव में तथाकथित के बाद ही एक वैज्ञानिक चरित्र प्राप्त हुआ डाल्टन का परमाणु सिद्धांत.
डाल्टन का परमाणु सिद्धांत यह परमाणु ज्ञान के विकास के लिए मौलिक था, क्योंकि यह अन्य वैज्ञानिकों के लिए परमाणु और इसकी विशेषताओं को जानने के लिए एक आधार के रूप में कार्य करता था।
कौन था जॉन डाल्टन?
जॉन डाल्टन, प्रशिक्षण द्वारा एक रसायनज्ञ, का जन्म 1766 में इंग्लैंड के कुम्ब्रिया में हुआ था और 1844 में मैनचेस्टर में उनकी मृत्यु हो गई थी। कम उम्र से, उनका जीवन वैज्ञानिक अनुसंधान और शिक्षण के लिए नियत था, इतना कि उन्होंने ज्ञान के विभिन्न क्षेत्रों के विकास में पढ़ाया या योगदान दिया।
हालांकि, एक वैज्ञानिक के रूप में उनकी सबसे बड़ी विरासत पहले परमाणु सिद्धांत का विकास था। गैसों के मिश्रण से संबंधित कई प्रयोगों और लैवोसियर द्वारा प्रस्तावित कार्यों के ज्ञान के माध्यम से ही डाल्टन का परमाणु सिद्धांत 1808 में उभरा।
डाल्टन के परमाणु सिद्धांत की अभिधारणाएँ
डाल्टन का परमाणु सिद्धांत प्रयोगों पर आधारित था, लेकिन इनमें से कोई भी प्रयोग परमाणु को स्पष्ट रूप से प्रकट नहीं कर सका। इसलिए डाल्टन ने परमाणु को पदार्थ का सबसे छोटा भाग कहा।
डाल्टन का सिद्धांत प्रमाणों की तुलना में कहीं अधिक अभिधारणा प्रस्तुत करता है। उनमें से कुछ देखें:
परमाणु आकार में बड़े और गोलाकार होते हैं (बिलियर्ड बॉल के समान);
परमाणु अविभाज्य हैं;
परमाणु अविनाशी हैं;
एक रासायनिक तत्व यह समान गुणों (आकार और द्रव्यमान) वाले परमाणुओं का एक समूह है;
विभिन्न रासायनिक तत्वों के परमाणुओं में एक दूसरे से भिन्न गुण होते हैं;
दो परमाणुओं के सापेक्ष भार का उपयोग उन्हें अलग करने के लिए किया जा सकता है;
विभिन्न प्रकार के परमाणुओं के एक ही संयोजन से एक यौगिक रसायन बनता है;
विभिन्न परमाणुओं के संयोजन से विभिन्न रासायनिक पदार्थ बनते हैं।
डाल्टन परमाणु मॉडल का प्रतिनिधित्व
डाल्टन ने अपने परमाणु मॉडल को बिलियर्ड बॉल नाम दिया और इसलिए, गोलाकार प्रतीकों के माध्यम से अपने समय में ज्ञात तत्वों के परमाणुओं का प्रतिनिधित्व करना शुरू कर दिया।
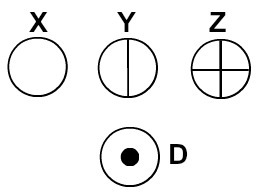
डाल्टन के परमाणु सिद्धांत के अनुसार परमाणुओं का प्रतिनिधित्व
प्रत्येक परमाणु प्रतिनिधित्व जिसमें एक विशिष्ट विवरण होता है, एक अलग रासायनिक तत्व को इंगित करता है। व्यावहारिक रूप से प्राथमिक और मध्यम स्तर की किताबें और अभ्यास अलग-अलग रंगों के गोले द्वारा परमाणुओं का प्रतिनिधित्व करते हैं।
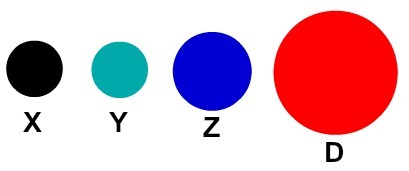
परमाणुओं का उपदेशात्मक प्रतिनिधित्व
डाल्टन के परमाणु सिद्धांत का योगदान
की समझना मास के संरक्षण का लैवोसियर का नियम
1785 में फ्रांसीसी रसायनज्ञ लैवोजियर ने दावा किया कि "रासायनिक प्रतिक्रिया में, द्रव्यमान संरक्षित होता है क्योंकि परमाणुओं का न तो निर्माण होता है और न ही विनाश होता है" ”. डाल्टन के परमाणु सिद्धांत ने इस तथ्य को साबित कर दिया, क्योंकि उनकी एक अभिधारणा में कहा गया है कि परमाणु अविनाशी है।
इसलिए, यदि हम ऑक्सीजन गैस (O .) की उपस्थिति में कोयले (C) का दहन करते हैं2), हमारे पास एक कार्बन परमाणु और दो ऑक्सीजन परमाणुओं के बीच एक रासायनिक प्रतिक्रिया होगी। यह प्रतिक्रिया कार्बन डाइऑक्साइड (CO .) बनाएगी2), जिसमें बिल्कुल वही परमाणु होते हैं जो प्रतिक्रिया से पहले पदार्थ बनाते हैं।
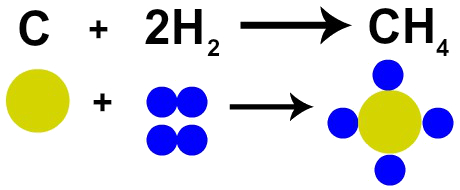
डाल्टन के परमाणु मॉडल द्वारा लवॉज़ियर के नियम का प्रतिनिधित्व
की समझना सरल पदार्थ
का उपयोग करते हुए डाल्टन का परमाणु मॉडल, हम एक साधारण पदार्थ को समझ सकते हैं, अर्थात्, जिसमें एक ही विशेषता के परमाणु होते हैं जो एक अणु बनाते हैं। इसलिए, हमारे पास एक ही रासायनिक तत्व से संबंधित परमाणु हैं।
पदार्थ F. में2उदाहरण के लिए, हमारे पास दो फ्लोरीन परमाणु हैं, इसलिए हमें डाल्टन के परमाणु सिद्धांत के अनुसार प्रतिनिधित्व में दो प्रकार के समान परमाणुओं का उपयोग करना चाहिए।

के अनुसार सरल पदार्थ निरूपण डाल्टन का परमाणु मॉडल
की समझना यौगिक पदार्थ
एक यौगिक पदार्थ में, हमारे पास अणु बनाने वाले विभिन्न विशेषताओं के परमाणु होते हैं। इसलिए, हमारे पास पदार्थ बनाने वाले विभिन्न रासायनिक तत्व हैं।
पदार्थ एच2उदाहरण के लिए, O में तीन परमाणु होते हैं: दो हाइड्रोजन और एक ऑक्सीजन। डाल्टन के परमाणु मॉडल के अनुसार इसका प्रतिनिधित्व देखें:
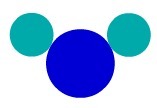
त्वचा के अनुसार एक यौगिक पदार्थ का प्रतिनिधित्वडाल्टन का परमाणु मॉडल
मिश्रण को समझना
डाल्टन के परमाणु सिद्धांत के माध्यम से मिश्रण (दो या दो से अधिक विभिन्न पदार्थों के मिलन) की समझ सरल है: एक ही कंटेनर में दो अलग-अलग अणुओं को रखें।

दूसरे मिश्रण का प्रतिनिधित्व डाल्टन का परमाणु मॉडल
जॉन डाल्टन द्वारा अन्य वैज्ञानिक योगदान
की अवधारणा पेश की परमाणु भार;
गैसों के आंशिक दबाव का कानून तैयार किया (डाल्टन का नियम);
दृष्टि दोष की खोज की जिसे कहा जाता है रंग अन्धता;
विभिन्न तापमानों पर वाष्प और गैसों के व्यवहार का अध्ययन किया;
उन्होंने पाया कि सभी गैसें एक ही तरह से अंतरिक्ष में फैलती हैं (वे एक निश्चित स्थान पर कब्जा करने की कोशिश करती हैं)।
मेरे द्वारा। डिओगो लोपेज डायस
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm
