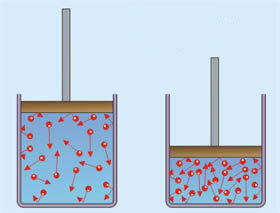
आंशिक दबाव, आंशिक दबाव का नियम, या डाल्टन का नियम वैज्ञानिक द्वारा प्रस्तावित किया गया था जॉन डाल्टन, जिसने कई मौसम संबंधी अध्ययन किए और वायुमंडलीय वायु की संरचना से संबंधित थे। उसके अनुसार,
“आंशिक दबाव वह बल है जो एक गैस के अणु एक कंटेनर की दीवारों पर लगाते हैं, जो बिल्कुल वैसा ही होता है जैसा कि अगर यह एक कंटेनर में होता तो यह होता गैस मिश्रण.”
इस निष्कर्ष के आधार पर, डाल्टन ने कहा कि गैस मिश्रण (कुल दबाव, पीटी) द्वारा exert में डाला गया दबाव एक कंटेनर की दीवारें इसमें शामिल प्रत्येक गैस के व्यक्तिगत आंशिक दबावों के योग के बराबर होती हैं मिक्स।
पीतो = पी + पीख + पीसी
जिसमें,
पी = गैस का आंशिक दबाव A pressure
पीख = गैस B. का आंशिक दाब
पीसी = गैस C. का आंशिक दाब
उदाहरण के लिए, यदि हमारे पास हाइड्रोजन गैसों (H .) द्वारा निर्मित मिश्रण है2), ऑक्सीजन (O .)2) और कार्बन डाइऑक्साइड (CO .)2) एक कंटेनर के अंदर, इस मिश्रण का दबाव इन गैसों में से प्रत्येक के दबावों के योग का परिणाम है, इस प्रकार:
पीतो = पीएच 2 + पीO2 + पीसीओ 2
1- आंशिक दबाव का कुल दबाव से संबंध
जॉन डाल्टन के अनुसार, के बीच संबंध आंशिक दबाव
एक निश्चित गैस (P .)) गैस मिश्रण का कुल दबाव हमेशा बराबर होता है दाढ़ अंश (एक्स) गैस, जिसके परिणामस्वरूप निम्न सूत्र प्राप्त होता है:पी = एक्स
पीतो
यह उल्लेखनीय है कि किसी गैस का मोलर अंश इस गैस के मोलों (nA) की संख्या के बीच संबंध द्वारा दिया जाता है तिल संख्या (एनटी) गैस मिश्रण का (परिणामस्वरूप मिश्रण बनाने वाली सभी गैसों की मोल संख्या के योग से)।
एक्स = नहीं न
नहीं नतो
इस प्रकार, यदि हम आंशिक दबावों के बीच संबंध की अभिव्यक्ति में गैस के दाढ़ अंश के सूत्र को प्रतिस्थापित करते हैं, तो हमारे पास है:
पी = नहीं न
पीतो नहीं नतो
2- गैस मिश्रण का कुल दाब
गैस मिश्रण का कुल दबाव न केवल इसे बनाने वाली गैसों के आंशिक दबावों को जोड़कर पाया जा सकता है। इसका उपयोग करके गणना की जा सकती है क्लैपेरॉन समीकरण:
अब मत रोको... विज्ञापन के बाद और भी बहुत कुछ है;)
पीतो.वीतो = एनतो.आर.टी
इस सूत्र का उपयोग कुल दबाव की गणना के लिए किया जा सकता है, जब तक कि कंटेनर की मात्रा (या गैसों की कुल मात्रा) और कुल मोल संख्या (एन) का उपयोग किया जाता है।तो), जा रहा है:
आर = सामान्य गैस स्थिरांक
टी = केल्विन में मिश्रण का तापमान
नोट: यदि तापमान डिग्री सेल्सियस में है, तो इसे केल्विन में बदल दें; ऐसा करने के लिए केवल 273 के साथ प्रदान किया गया मान जोड़ें।
3- गैस के आंशिक दाब के अनुप्रयोग का उदाहरण
उदाहरण: (FEI SP) 273K पर रखे 44.8L कंटेनर में, CNTP में 4 mol हाइड्रोजन गैस और 6 mol ऑक्सीजन गैस मिलाई गई। H. का आंशिक दबाव2 यह है2, वायुमंडल में, क्रमशः हैं:
ए) 1.0 और 2.0
बी) 3.0 और 4.5
सी) 0.8 और 1.2
घ) 1.0 और 1.5
ई) 2.0 और 3.0
अभ्यास द्वारा प्रदान किया गया डेटा:
तापमान = २७३ के
सिस्टम वॉल्यूम = ४४.८ एल
हाइड्रोजन गैस के मोलों की संख्या = 4 मोल
ऑक्सीजन गैस के मोलों की संख्या = 6 मोल
पीएच 2= ?
पीO2= ?
1हे चरण: कुल मोल संख्या की गणना करें
नहीं नतो = एनएच 2 + नहींO2
नहीं नतो = 4 + 6
नहीं नतो = 10 मोल
2हे चरण: क्लैपेरॉन समीकरण का उपयोग करके सिस्टम के कुल दबाव (पीटी) की गणना करें
पीतो.वीतो = एनतो.आर.टी
पीतो.44,8 = 10.0,082.273
पीतो.44,8 = 223,86
पीतो = 223,86
44,8
पीतो = 4.996875 एटीएम, फिर पीतो यह लगभग 5 एटीएम है
3हे चरण: हाइड्रोजन गैस के आंशिक दबाव की गणना करें
पीएच 2 = नहीं नएच 2
पीतो नहीं नतो
पीएच 2 = 4
5 10
पीएच 2.10 = 4.5
पीएच 2.10 = 20
पीएच 2 = 20
10
पीएच 2 = 2 एटीएम
4हे चरण: ऑक्सीजन गैस के आंशिक दबाव की गणना करें
चूंकि हमारे पास मिश्रण में केवल दो गैसें हैं और हम उनमें से एक के दबाव और कुल दबाव को जानते हैं, ऑक्सीजन गैस के आंशिक दबाव की गणना करने के लिए, मिश्रण के कुल दबाव की अभिव्यक्ति का उपयोग करें:
पीतो = पीएच 2 + पीO2
5 = 2 + पीO2
पीO2 = 5 – 2
पीO2 = 3 एटीएम
मेरे द्वारा। डिओगो लोपेज डायस
क्या आप इस पाठ को किसी स्कूल या शैक्षणिक कार्य में संदर्भित करना चाहेंगे? देखो:
DAYS, डिओगो लोपेज। "गैसों का आंशिक दबाव"; ब्राजील स्कूल. में उपलब्ध: https://brasilescola.uol.com.br/quimica/pressao-parcial-dos-gases.htm. 27 जून, 2021 को एक्सेस किया गया।
किसी पदार्थ के द्रव्यमान, आणविक द्रव्यमान, परमाणुओं से बने अणुओं की गणना कैसे करें, सहसंयोजक और आयनिक बंधन, पदार्थों के सूत्र में निहित परमाणु, परमाणुओं का योग, का द्रव्यमान अणु