पर सहसंयोजी आबंध, यह भी कहा जाता है आणविक या होमोपोलर बांड, वे हैं जो के परमाणुओं के बीच होते हैं विद्युत ऋणात्मक तत्व, अर्थात्, इलेक्ट्रॉनों को प्राप्त करने की प्रवृत्ति के साथ, bond का एक बंधन स्थापित करना अपने संयोजकता कोशों से इलेक्ट्रॉनों का बंटवारा।
सहसंयोजक बंधन निम्नलिखित तत्वों के बीच हो सकता है: हाइड्रोजन, गैर-धातु और अर्ध-धातु। इस प्रकार के बन्धन में धातुएँ कभी भी भाग नहीं लेती हैं।
आइए एक सहसंयोजक बंधन के एक सरल उदाहरण पर विचार करें: हाइड्रोजन गैस बनाने वाला बंधन (H .)2):
एच + एच → एच2
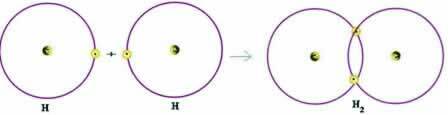
ध्यान दें कि दोनों परमाणुओं को ऑक्टेट नियम के अनुसार - अपने वैलेंस शेल को पूरा करने के लिए एक इलेक्ट्रॉन प्राप्त करने की आवश्यकता होती है - और इस तरह, स्थिर रहने के लिए। इसलिए, उन्होंने अपने इलेक्ट्रॉनों को साझा किया और, इस तरह, उन दोनों के पास दो इलेक्ट्रॉन थे, उनका पूरा के-शेल था और महान गैस हीलियम का विन्यास प्राप्त हुआ था।
इलेक्ट्रॉनों का यह साझाकरण इस प्रकार के बंधन को आयनिक बंधन से अलग करता है, जिसमें इलेक्ट्रॉन स्थानांतरण होता है।
इस मामले के दो और उदाहरणों के लिए नीचे दिया गया चित्र देखें:
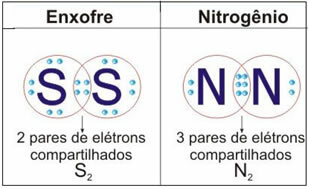
इस प्रकार के बंधन में अणुओं का निर्माण होता है, जिसे उनके संबंधित द्वारा दर्शाया जा सकता है आणविक सूत्र, अर्थात्, सबसे सरल निरूपण जो इंगित करता है कि अणु में प्रत्येक तत्व के कितने परमाणु हैं। आण्विक सूत्रों के कुछ उदाहरण हैं: एच2, सा2, ओ2, नहीं न2, हो2ओ, सीओ2, आदि।
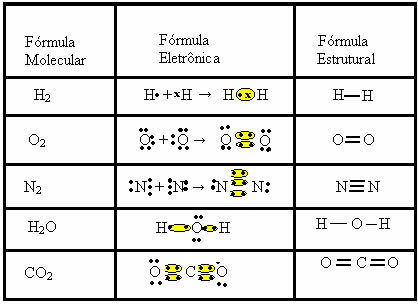
सहसंयोजक बंधन को दो अन्य सूत्रों द्वारा दर्शाया जा सकता है:
- इलेक्ट्रॉनिक फॉर्मूला या लुईस फॉर्मूला: इस सूत्र में प्रत्येक परमाणु के संयोजकता कोश के इलेक्ट्रॉन और इलेक्ट्रॉनिक युग्मों का निर्माण भी दिखाई देता है। इन इलेक्ट्रॉनों को संकेतों द्वारा दर्शाया जाता है . या एक्स;
- फ्लैट स्ट्रक्चरल फॉर्मूला या कूपर स्ट्रक्चरल फॉर्मूला: तत्वों के लिंक दिखाता है, जिसमें प्रत्येक साझा जोड़ी एक डैश के अनुरूप होती है। अगर यह सिर्फ एक डैश है तो हम इसे सिंगल लिंक कहते हैं; यदि दो हैं, तो दोहरा बंधन; और अगर तीन डैश हैं, तो ट्रिपल बॉन्ड।
इन तीन रासायनिक सूत्रों द्वारा दर्शाए जा रहे सहसंयोजक बंधों के अन्य उदाहरणों को देखें:
जेनिफर फोगाका द्वारा
रसायन विज्ञान में स्नातक
स्रोत: ब्राजील स्कूल - https://brasilescola.uol.com.br/quimica/ligacoes-covalentes.htm
